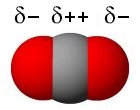

Hiiliatomilla on uloimmalla elektronikuorellaan neljä elektronia ja happpiatomilla kuusi elektronia. Lukion oppikirjoissa hiilidioksidimolekyylin rakenne kuvataan tavallisesti siten, että hiiliatomin ja kummankin happiatomin välillä on kaksoissidos ja kummallekin happiatomille jää kaksi vapaata elektroniparia. Tällöin on johdonmukaista merkitä osittaisvaraukset molekyyliin siten, että molempiin happiatomeihin muodostuu negatiivinen osittaisvaraus.
Itse asiassa hiilidioksidimolekyylissä hiiliatomin ja molempien happiatomien välillä on yksinkertainen σ-sidos. Hiiliatomin ja happiatomien 2px and 2py -orbitaalit osuvat tällöin sopivasti kohdakkain. Näiden orbitaalien yhtyminen (overlap) tuottaa koko molekyylin pituudelle leviävän π-orbitaalin. Tällä tavoin syntynyt π-sidos on vahva. Niinpä hiilidioksidi muodostuukin erillistä CO2-molekyyleistä. Molekyylin geometriasta taas johtuu, että molekyyli on pooliton. Seurauksena on, että ainoiksi CO2-molekyylien välisiksi sitoviksi voimiksi jäävät heikot dispersiovoimat.

Hiilidioksidimolekyylin sidosrakenteen kuvaaminen täsmällisesti sidosviivoilla ja vapailla elektronipareille on hieman hankalaa. Joskusrakenen esitetään neljän resonanssimuodon avulla. Kunkin muodon arvellaan vaikuttavan 25 %:n osuudelta resonanssihybridiin.
Kaksipäiset nuolet kuviossa eivät tarkoita reaktiotasapainoa vaan kertovat eri rakennekaavoin esitettyjen muotojen kuuluvan resonanssihybridiin. Muistatathan, että kyseessä ei ole muotojen muuttuminen toiseksi vaan rakenne, jossa eri muodot yhdistyvät. (Vähän kuten muuli syntyy hevosen ja aasin risteymänä eikä suinkaan muutu välillä hevoseksi ja välillä aasiksi.)
