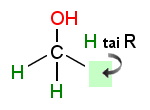
ROH tarkoittaa tässä primaarista pienimolekyylistä alifaattista alkoholia.
Ihmiselimistössä etanoli CH3CH2OH hapettuu asteittain entsyymien (alkoholidehydrogenaasi ja aldehydidehydrogenaasi) katalysoimissa reaktioissa. Yksinkertaistettuina reaktiot ovat seuraavat:
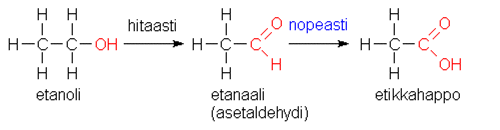 |
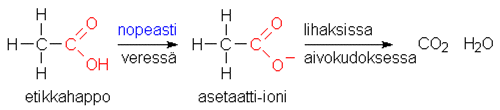 |
Lopputuotteet ovat samat kuin etanolin täydellisessä palamisreaktiossa:
Energiaa etanolin palamisessa vapautuu runsaasti, n. 30 kJ/g. Vertailun vuoksi mainittakoon, että hiilihydraateista saadaan energiaa noin 17 kJ/g ja rasvasta 38 kJ/g.
Primaarisen, sekundaarisen ja tertiaarisen alkoholin
hapettumisreaktioiden vertailu
Schunk, A.
Experiment des Monats Juli 1999: Alkohol-Oxidation
| Alkoholin hapettaminen karboksyylihapoksi: ROH → RCOOH | |
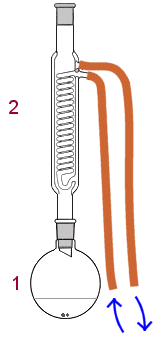 |
Alkoholi hapettuu helposti karboksyylihapoksi, joten haluttaessa valmistaa karboksyylihappoa annetaan reaktion tapahtua ensin ja erotetaan sitten tuote reaktioseoksesta. Hapettimena voidaan käyttää kaliumdikromaatin ja
rikkihapon seosta. Kolviin (1) pannaan alkoholi ja hapetin, joita keitetään palautusjäähdyttimen (2) alla. Reaktiossa syntyvä karboksyylihappo jää kolviin. Tuote erotetaan alkoholista riippuen eri tavoin. Siniset nuolet osoittavat vesikierron suunnan palautusjäähdyttimessä. |
| Alkoholin hapettaminen aldehydiksi: ROH → RCHO | |
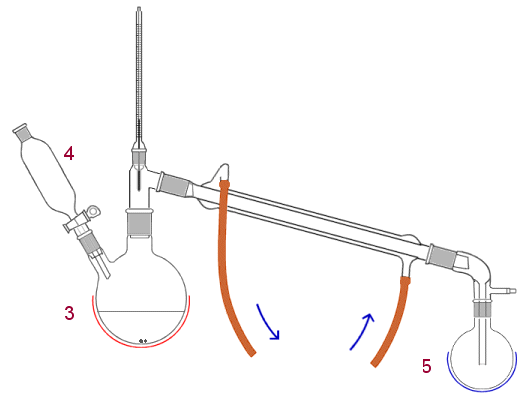 |
Hapetettava alkoholi sijoitetaan kolviin (3), jota lämmitetään tarvittaessa. Hapetin pannaan tiputussuppiloon (4). Aldehydi kerätään kolviin (5), jota jäähdytetään. |
| Hapetin on lisättävä hitaasti tiputtamalla, jottei sitä jäisi ylimäärin reaktioseokseen. Aldehydiä on tislattava jatkuvasti pois, ettei se ehtisi hapettua karboksyylihapoksi. | |
| Siniset nuolet osoittavat vesikierron suunnan Liebig-jäähdyttimessä. | |
Alkometrin toiminta voi perustua etanolin hapettamiseen dikromaatilla. Katalyyttinä käytetään tällöin hopeanitraattia AgNO3.
Dikromaatti-ionin Cr2O72–(aq) keltaoranssi väri väistyy kromi(III)-ionin Cr3+(aq) vihreän värin tieltä sitä selvemmin, mitä runsaammin alkometriin puhalletussa ilmassa on etanolia.
Alkometrissä on kaksi ampullia. Toinen ampulli rikotaan puhallettaessa. Toista käytetään vertailuun.
Veren alkoholipitoisuus saadaan promilleina asteikolta, jonka mukaan 2100 ml uloshengitysilmaa sisältää saman määrän alkoholia kuin 1 ml verta.
Ensimmäinen platinaelektrodi (+) hapettaa etanolin etikkahapoksi. Hapettumisessa luovutetut elektronit kulkevat johdinta pitkin toiselle platinaelektrodille (–). Reaktiossa vapautuvat protonit siirtyvät elektrolyytin kautta ja yhtyvät ilman hapen sekä johtimesta tulevien elektronien kanssa toisella Pt-elektrodilla muodostaen vettä.
Johtimessa kulkevan virran voimakkuus on sitä suurempi, mitä enemmän etanolia hapettuu, ts. mitä enemmän etanolia hengitysilmassa alkuaan oli hapetettavaksi. Mikroprosessori mittaa virran ja laskee etanolipitoisuuden.
IR-menetelmä pohjautuu siihen, että molekyylit värähtelevät koko ajan ja pystyvät siksi absorboimaan sopivan taajuista IR-säteilyä. Eri sidostyypeillä on omat absorptiomaksiminsa, joiden avulla molekyylejä voidaan tunnistaa. Niinpä etanoli on tunnistettavissa ja sen määrä mitattavissa riippumatta muista uloshengitysilman sisältämistä aineista. Etanolista mitataan C–O-, O–H-, C–H- ja C–C-absorptio. Absorption suuruus on verrannollinen etanolin määrään näytteessä.