
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
Kuva esittää natriumkloridin NaCl kidehilan purkautumista vesimolekyylien vaikutuksesta eli NaCl:n liukenemista veteen.

NaCl:n kidehilaa pitävät koossa positiivisten Na+- ja negatiivisten Cl– -ionien väliset sähköstaattiset vetovoimat. Hilassa ionit värähtelevät sidosten rikkoutumatta.
Vedessä vesimolekyylejä sitovat osittain toisiinsa vetysidokset happiatomien ja toisten vesimolekyylien vetyatomien välillä. Liuoksessa kuitenkin vesimolekyylit ovat liikkeessä koko ajan törmäillen toisiinsa ja kidehilaan, jolloin vetysidoksia sekä katkeilee että syntyy. Koska vesimolekyylit ovat dipoleja, suotuisissa törmäyksissä kidehilaan ne suuntautuvat kohti ioneja siten, että dipolin negatiivinen pää eli happiatomin puoli lähestyy Na+-ionia ja dipolin positiivien pää puolestaan suuntautuu Cl–-ionia kohti. Vesimolekyylien jatkuvan pommituksen takia reunimmaiset ionit irtautuvat hilasta ja siirtyvät vesimolekyylien ympäröiminä liuokseen.
Vesimolekyylit peittävät ionien sähkövarauksen asettumalla ionien ympärille hydraattiverhoksi, jossa vesimolekyylin ja ionin välillä on ioni-dipolisidos. Hydraattiverho estää ionien välisten sähköstaattisten vetovoimien synnyn.
Reaktioyhtälö:
Rakennekaavat
Kivihiili voi sisältää rikkiä ja rikkiyhdisteitä vaihtelevia määriä. Rikin ja sen yhdisteiden palaessa syntyy rikkidioksidia SO2.
Sekä rikkidioksidi että siitä ilmassa hapettunut SO3 reagoivat veden kanssa. Näin syntyy rikkihapoketta H2SO3 sekä rikkihappoa H2SO4. Reaktio voi tapahtua veden kanssa ilmassa (pilvet, ilman kosteus), maassa, kasvustossa tai vesistöissä. Rikkiyhdisteistä aiheutuva hapan laskeuma voi siis sisältää em. happoja mutta myös reagoimattomia rikin oksideja, jotka ilman hiukkasepäpuhtauksiin takertuneina laskeutuvat maahan ja vesistöihin.
| Rikin palaminen: | S + O2 → SO2 |
| Rikkidioksidin hapettuminen: | 2 SO2 + O2 → 2 SO3 |
| Reaktiot veden kanssa: | SO2 + H2O
→
H2SO2 SO3 + H2O → H2SO4 |
| Protolyysi:
Molemmat hapot ovat kaksiarvoisia, joten
toinenkin protolyysireaktio tapahtuu. |
H2SO3 + H2O
→ H3O+ +
HSO3– H2SO4 + H2O → H3O+ + HSO4– |
Happamoitumista voidaan vähentää poistamalla kivihiilen palamiskaasuista rikin oksideja. Esimerkiksi polttomenetelmä, jossa kivihiili ensin kaasutetaan ja kaasut poltetaan kahdessa vaiheessa, antaa mahdollisuuden jonkin asteiseen puhdistukseen.
Jo tapahtuneen happamoitumisen vaikutuksia esim. maaperään ja vesistöihin voidaan vähentää kalkituksella, koska kalkki Ca(OH)2 emäksisenä aineena neutraloi happamia liuoksia. Kalkin OH– -ionit reagoivat oksoniumionien H3O+ kanssa. Kalsiumionit sitovat sulfaatin suolaksi CaSO4. Kalsiumsulfaatti on niukkaliukoinen yhdiste, mikä on jossakin määrin ongelmallista, sillä liuoksissa sulfaatti-ionit olisivat biologisesti käyttökelpoisia: maaperästä tai vedestä ne päätyisivät kasvien ja bakteerien käyttöön.
a) BrØnstedin mukaan happo luovuttaa protonin ja emäs vastaanottaa protonin protolyysireaktioissa.
| HCl | + | H2O | Cl – | + | H3O+ | |
| happo 1 | emäs 2 | emäs 1 | happo 2 |
b) Kuta vahvempi happo on, sitä herkemmin se luovuttaa protonin, ja kuta vahvempi emäs on, sitä herkemmin se sitoo protonin.
Heikko happo ei protolysoidu täydellisesti protolyysireaktiossaan. Sen protolyysin seurauksena esim. vesiliuokseen jää aina runsaasti reagoimatonta happoa protolyysituotteiden ohella. Vastaavasti heikko emäs jää suurelta osin protonoitumatta. Esim. etikkahappo CH3COOH on heikko happo, jonka vesiliuoksessa on aina läsnä oksoniumionien H3O+ ja asetaatti-ionien CH3COO– lisäksi ja huomattavasti niitä enemmän kokonaisia etikkahappomolekyylejä CH3COOH, kun taas vahvan vetykloridihapon vesiliuoksessa ei ole käytännöllisesti katsoen lainkaan ehjiä HCl-molekyylejä. Ammoniakki NH3 on heikko emäs, jonka vesiliuoksessa on hydroksidi-ionien OH– ja ammoniumionien NH4+ lisäksi (enemmistönä) ammoniakkimolekyylejä.
| Vahva happo: | HCl + H2O
|
Tasapaino oikealla. |
| Heikko happo: | CH3COOH + H2O
|
Tasapaino vasemmalla. |
c) Olkoon HA heikko yksiarvoinen happo ja NaA sen natriumsuola. Hapon protolyysireaktio on:
Reaktion mukaan happovakio Ka =
[H3O+] · [A– ] :
[HA]
Veden ionitulo on määritelmän mukaan
Kw = [H3O+ ] · [OH
– ]
Ka : Kw = [H3O+ ] · [OH – ] : [H3O+] · [A– ] –1· [HA] = [HA] : [A– ] · [ OH– ] = [OH– ]
sillä ehdolla, että [HA] = [A– ] eli anionin konsentraatio on yhtä suuri kuin suolan konsentraatio. Oletuksen mukaan tämä ehto on voimassa. (Liuenneen suolan tuottamien anionien konsentraatio on sama kuin suolan konsentraatio: NaA → Na++ A– )
a) Ammoniakin valmistus typestä ja vedystä:
| Aine | Alussa | Tasapainossa mmol/l | T.p. mol/l |
| N2 | 25 | 25 – 12 = 13 | 0,013 |
| H2 | 99 | 99 – 3 · 12 = 63 | 0,063 |
| NH3 | 0 | 24 | 0,024 |
V = 1 l
K =
(0,024 mol/l)2 : [0,013 mol/l · (0,053
mol/l)3] = 177,197 l2/mol2 = 177
l2/mol2
| Aine | Alussa | Tasapainossa mmol | T.p. mol |
| N2 | 25 | 25 – 15 =10 | 0,010 |
| H2 | 99 | 99 – 3 · 15 = 54 | 0,054 |
| NH3 | 0 | 30 | 0,030 |
Taulukkokirjan normaalipotentiaalitaulukosta näkyy, että sinkin Zn /Zn2+ ja hopean Ag+ /Ag välille saadaan tarjotuista aineista suurin jännite: sinkki on valikoiman, Zn, Pb, Cu, Ag, epäjaloin metalli ja hopea jaloin.
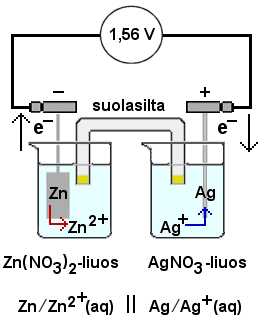 Rakennetaan kenno sijoittamalla sinkkilevy
Zn(NO3)2-liuokseen ja hopealanka
AgNO3-liuokseen, kumpikin omaan astiaansa. Yhdistetään
astiat suolasillalla (esim. KCl-liuoksella perusteellisesti kostutettua vanua
tiiviisti lasiputkessa), jotta hapettumis-pelkistymisreaktio pääsee
tapahtumaan.
Rakennetaan kenno sijoittamalla sinkkilevy
Zn(NO3)2-liuokseen ja hopealanka
AgNO3-liuokseen, kumpikin omaan astiaansa. Yhdistetään
astiat suolasillalla (esim. KCl-liuoksella perusteellisesti kostutettua vanua
tiiviisti lasiputkessa), jotta hapettumis-pelkistymisreaktio pääsee
tapahtumaan.
| Zn →Zn2+ + 2 e– | +0,76 V |
| 2 Ag+ + 2 e– → Ag | +0,80 V |
| 2 Ag+ + Zn→ 2 Ag + Zn | +1,56 V |
Kennon laskennalliseksi jännitteeksi saadaan 1,56 V, mutta käytännössä ihan tähän arvoon ei päästä. Kennoa kuormitettaessa sinkkilevy syöpyy eli sinkkiä liukenee ja Zn(NO3)2-liuos väkevöityy. Hopealangan pintaan saostuu hopeaa ja AgNO3-liuos laimenee. Nitraatti-ionikonsentraatio tasapainottuu ionien vaeltaessa suolasiltaa pitkin astiasta toiseen.
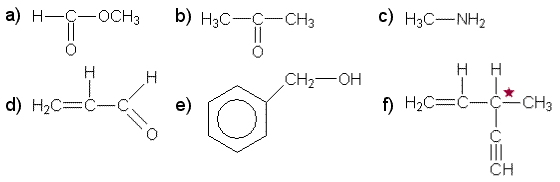
Isomeria on ilmiö, joka syntyy siitä, että yhdisteillä on sama molekyylikaava mutta erilainen rakenne. Kuta useampia atomeja molekyylikaavassa on, sitä useammat erilaiset rakenteet ovat mahdollisia. Konformaatioisomeerejä lukuun ottamatta isomeerit ovat eri yhdisteitä, joiden fysikaaliset ja kemialliset ominaisuudet saattavat poiketa toisistaan hyvinkin paljon. Orgaanisten yhdisteiden isomeriaa kuvattaessa tarvitaan seuraavien isomerian lajien käsittelyä.
Kaikista isomerian lajeista tulisi olla mukana selkeä rakennekaavoin piirretty esimerkki. Lisäksi tarvitaan esimerkkejä isomeerien erilaisista kemiallisista tai fysikaalisista ominaisuuksista. Optisen isomerian yhteydessä on hyvä muistaa luonnonaineille tyypillinen yhden optisen isomeerin esiintyminen (esim. proteiinien L-aminohapot ja sokerien vallitseva D-muotoisuus) ja sen vertailukohtana synteeseissä usein tuotteina saadut raseemiset seokset, joista eri isomeerien erottaminen on hyvin vaikeaa. Biotekniset menetelmät tosin nykyään tekevät mahdolliseksi puhtaidenkin optisten isomeerien tuottamisen.