| Kennoreaktio | E/V | ||
| Na+ + e– | Na | – 2,71 | |
| Zn2++ 2 e– | Zn | – 0,76 | |
| Cu2++ 2 e– | Cu | + 0,34 | |
| Au++ e– | Au | +1,69 | |
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Epäjalo metalli –
jalometalli
Metallien jalous määritellään niiden
pelkistymisreaktioiden perusteella. Pelkistymistä verrataan
normaalivetyelektrodin vedyn pelkistymisreaktioon 2 H+ +
2e– → H2, jonka
normaalipotentiaali on 0. Jalometallit pelkistyvät helpommin kuin
H+, ja niiden normaalipotentiaalien arvot ovat positiivisia.
Epäjalot metallit pelkistyvät vaikeammin kuin H+ ja niiden
normaalipotentiaalien arvot ovat negatiivisia. Kuta suurempi
normaalipotentiaalin arvo on, sitä jalompi metalli on kyseessä.
| Kennoreaktio | E/V | ||
| Na+ + e– | Na | – 2,71 | |
| Zn2++ 2 e– | Zn | – 0,76 | |
| Cu2++ 2 e– | Cu | + 0,34 | |
| Au++ e– | Au | +1,69 | |
Tai
Metallien jännitesarjassa epäjalot metallit sijoittuvat
vedyn vasemmalle puolelle ja jalometallit oikealle puolelle. Happojen
kanssa reagoidessaan epäjalot metallit vapauttavat niistä vetyä.
Jalometallit joko eivät reagoi happojen kanssa tai reaktiossa syntyy muuta
kaasua kuin vetyä tai muodostuu kompleksi-ioni. Epäjalotkaan metallit
eivät aina reagoi havaittavasti happojen kanssa, jos metallin pinta
passivoituu.
Esimerkki Epäjalo sinkki ja
jalometalli kupari:
Osa jännitesarjaa (taulukkokirja s.143)
Jännitesarjan oikeanpuoleinen metalli pystyy hapettamaan vasemmanpuoleisen sen suolaliuoksesta.
Huom. Esimerkit voivat olla muitakin tai niitä voi olla vähemmän. Kuparin reaktio on turhan vaikea.
b) Vahva happo – heikko happo
Hapon vahvuus
määritellään sen (vesiliuoksessa tapahtuvan)
protolyysireaktion pohjalta. Vahvat hapot protolysoituvat täydellisesti,
heikot hapot vain osittain. Vahvoja happoja ovat mm. vetykloridi HCl,
typpihappo HNO3 ja rikkihappo H2SO4. Heikkoja
happoja ovat esimerkiksi etikkahappo CH3COOH ja hiilihappo
H2CO3. Heikon hapon vahvuutta kuvaa sen
protolyysireaktion tasapainovakio Ka (happovakio).
Esimerkki
| HCl + H2O → Cl– + H3O+ | Protolysoituvat täydellisesti. |
| CH3COOH + H2O → CH3COO– + H3O+ | Ka = 1,8 · 10 –5 mol/l (pKa = 4,74) |
Happo on sitä vahvempi, mitä suurempi sen
Ka-arvo on (ja mitä pienempi sen pKa
-arvo on).
pKa = –
logKa.
Hyvin vahvan hapon, kuten HCl , Ka ei ole määritelty, koska happo protolysoituu vesiliuoksessa täydellisesti, joten protolysoitumattomien happomolekyylien konsentraatio on 0.
c) Kiteinen aine – amorfinen aine
Sekä kiteinen aine
että amorfinen aine ovat kiinteän aineen esiintymismuotoja.
Kiteisessä aineessa rakenneyksiköt ovat järjestyneet
säännölliseen kidehilaan. Rakenneyksiköitä voivat ovat
atomit (metallikiteissä), ionit (esim. NaCl ) tai molekyylit (esim.
sakkaroosi). Amorfisen aineen rakenneyksiköillä ei ole tarkkaa
järjestystä.. Esimerkiksi lasi on amorfinen aine, joka koostuu
pääasiassa piin ja alkalimetallien oksideista. Lasi ei kuitenkaan ole
seos, sillä sen rakennetta pitävät koossa vahvat kemialliset
sidokset.
d) Emäksinen oksidi – hapan oksidi
Emäksinen
oksidi tuottaa veteen liuetessaan emäksisen liuoksen ja hapan oksidi
vastaavasti happaman liuoksen. Emäksisiä oksideja ovat alkali- ja
maa-alkalimetallien oksidit (mm. Na2O, CaO), happamia oksideja taas
ovat epämetallien oksidit (mm. CO2, SO3).
Esimerkki
a) Reaktioyhtälön kertoimet (helpointa lienee aloittaa tasapainottaminen vedystä, typestä ja hapesta):
b) n(kaasut) = 3,76 l : 22,4 l/mol = 0,1679 mol
(NTP)
Reaktioyhtälön mukaan
n(TNT) :
n(kaasut) = 2 : (12 + 2 + 3) = 1 : 10
n(TNT) =
0,01679 mol
Räjähtäneen TNT:n massa
m(TNT) =
0,01679 mol · 227,13 g/mol = 3,81 g
a) Reaktion yhtälö:
b) Reaktio on eksoterminen, koska astia lämpeni selvästi.
c) Alkuperäinen HCl:n
ainemäärä:
n(HCl) = c(HCl)
·V(HCl)
n(HCl) = 0,400 M · 0,500
l = 0,200 mol
Magnesiumin ainemäärä:
n(Mg) =
m(Mg) : M(Mg)
n(Mg) = 2,00 g : 24,31
g/mol = 0,08227 mol
Reagoimatonta vetykloridia:
0,200 mol – 2 ·
0,08227 mol = 0,03546 mol
c(HCl) = 0,03546 mol : 0,500 l
pH = –log ( 0,03546 : 0,500) = 1,15
Huom. Myös pH-arvo 1,149 hyväksyttiin, mutta pH-arvon ilmoittamisesta yhdellä desimaalilla vähennettiin 1/3 pistettä.
a) Isomeeriset yhdisteet ovat joko alkoholeja tai eettereitä.


b) Optista isomeriaa esiintyy yhdisteellä 3, koska siinä on asymmetrinen hiiliatomi (johon OH-ryhmä on liittynyt).
c) Vain alkoholit 1, 2 ja 3 voivat hapettua. Alkoholeista 1 ja 2 syntyy aldehydejä (jotka olosuhteista riippuen voivat hapettua edelleen karboksyylihapoiksi, mutta tehtävässä tarkoitettaneen pelkästään aldehydejä). Yhdiste 1hapettuu yhdisteeksi 8, yhdisteestä 2 tulee aldehydi 9. Sekundaarisesta alkoholista 3 syntyy ketoni 10.

a) Kun 1,00 litran astiaan suljettiin 0,100 mol
metaania ja 0,120 mol vettä ja lämpötila nostettiin
750 °C:seen, muodostui astiaan tasapainotilan asetuttua 0,270 mol
vetyä.
Reaktioyhtälö
| CH4(g) + H2O(g)
|
 |
Tasapainovakion lauseke K = [H2]3[CO] : ([CH4][H2O])
b) Tasapainokonsentraatiot
[H2] = 0,270 mol
/ l
Reaktioyhtälön mukaan hiilimonoksidia syntyy 1/3 vedyn
määrästä, joten
[CO] = 0,090 mol/ l.
Koska kaikki
O-atomit ovat peräisin vedestä,
[H2O] = (0,120 mol
– 0,090 mol)/l = 0,030 mol/l
Koska kaikki hiili on peräisin
metaanista,
[CH4] = (0,100 mol – 0,090 mol)/ l = 0,010
mol/l
Sijoitetaan arvot tasapainovakion
lausekkeeseen:
0,2703· 0,090 : (0,010 · 0,030) mol2/l2 = 5,90 mol2/l2
c) Reaktio tapahtuu kaasufaasissa, joten paineen kasvu siirtää tasapainoa siihen suuntaan, missä kaasumolekyylejä on vähemmän (lähtöaineiden suuntaan). Vetyä syntyy siis vähemmän, koska paine lisääntyy astian tilavuuden pienetessä 1,00 litrasta 0,500 litraan.
a) Reaktio on ammoniakkisynteesi. Lähtöaineina ovat typpi ja vety. Vedyn määrä lähtötilanteessa on kolminkertainen typpeen verrattuna eikä ammoniakkia ole lainkaan. Tasapainotilassa ammoniakkia on kaksinkertainen määrä typpeen verrattuna.
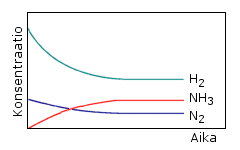
b) Reaktion käynnistyessä ammoniakin konsentraatio alkaa kasvaa ja typen sekä vedyn konsentraatio pienetä. Konsentraatiot muuttuvat selvästi siihen asti, kunnes saavutetaan tasapainotila. Vaikka tasapaino on dynaaminen konsentraatioiden minimaaliset muutokset eivät näy käyrissä, vaan käyrät tasaantuvat vaakasuoriksi viivoiksi.
c) Etenevä reaktio hidastuu lähtöaineiden konsentraatioiden pienetessä. Käänteisen (palautuvan) reaktion nopeus lisääntyy sitä mukaa kuin tuotteiden konsentraatio kasvaa. Tasapainossa molempien reaktioiden nopeudet ovat yhtä suuret.
HNO3-liuoksen valmistus ja konsentraation tarkistus
1. Lasketaan tarvittava HNO3:n
ainemäärä.
n(HNO3) = 0,100 mol/l
· 500 ml = 0,050 mol
m(HNO3) = 0,050
mol · 63,01 g/mol = 3,1505 g
2. Koska käytettävissä on 36 massa-%
HNO3-liuosta, lasketaan, kuinka suuri tilavuus typpihappoa on
mitattava.
Merkitään x = mitattavan 36 %
HNO3-liuoksen massa
m(HNO3) = 0,36
· x = 3,1505 g
x = 8,751 g
V(HNO3 36 %) = 8,751 g : 1,214 kg/l = 7,21
ml
3. Mitataan mittapipetillä (tai byretistä) 7,2 ml väkevää HNO3-liuosta 500 ml:n mittapulloon. Täytetään mittapullo tislatulla vedellä merkkiin saakka ja sekoitetaan hyvin kääntelemällä pulloa ylös ja alas korkkia kädellä tukien.
 |
Mitattaessa on varottava happoroiskeita. Hansikkaat käteen ja suojalasit päähän! Väkevässä HNO3-liuoksessa on pistävä haju. On parasta tehdä mittaus vetokaapissa. |
4. Valmistetun HNO3-liuoksen pitoisuus voidaan tarkistaa titraamalla NaOH-liuoksella. Koska liuoksen konsentraatioksi tavoiteltiin arvoa 0,100 mol/l, titraukseen sopii esimerkiksi 0,050 M NaOH-liuos. Sitä kuluu 5 ml:n näytettä kohti noin 10 ml. Titrausliuos pannaan byrettiin (V = 50 ml). Mitataan 5 ml:n täyspipetillä näyte HNO3-liuoksesta keitinpulloon. Lisätään indikaattoriksi esim. pisara fenoliftaleiinia. Titrataan juuri ja juuri punertavaksi. Toistetaan määritys uudesta näytteestä.
Tuloksen laskeminen
c(HNO3) = c(NaOH)
· V(NaOH) : V(HNO3)
Hiilivedyt. Miten hiilivedyn rakenne vaikuttaa sen kemiallisiin ja fysikaalisiin ominaisuuksiin?
Aihe on varsin laaja, joten rajaukset ovat tarpeen. Ohessa jäsennysehdotus. Se ei suinkaan pyri olemaan ainoa oikea, jokeriin voi aina vastata monella erinomaisella tavalla.
Jako "tyydyttyneet — tyydyttymättömät —aromaattiset" on syytä käsitellä tarkasti. Sidosrakenne: tetraedri (sp3), kaksoissidos (sp2), kolmoissidos (sp), aromaattisuus, π-elektronit
Esimerkkejä tietysti jokaisesta mukaan ja perustelut reaktiotyyppiin hiilivedyn rakenteen pohjalta!