
Kopioi alla oleva taulukko vastauspaperiisi ja täytä siinä olevat avoimet kohdat käyttäen hyväksesi alkuaineiden jaksollista järjestelmää.
| Alkuaineen / ionin symboli | 5426Fe2+ | |||
| Protonien määrä | 79 | |||
| Neutronien määrä | 16 | 117 | 136 | |
| Elektronien määrä | 18 | 79 | ||
| Massaluku | 222 | |||
| Kokonaisvaraus | -3 | 0 |
Titaani on luja, kevyt ja korroosiota kestävä metalli, jota käytetään mm. lentokoneissa, polkupyörien rungoissa ja raketeissa. Sitä valmistetaan titaani(IV)kloridin ja sulan magnesiumin välisessä reaktiossa lämpötilassa 950 – 1150 °C.
Eräässä teollisuusprosessissa lähtöaineina käytettiin 35,4 kg TiCl4 ja 8,3 kg magnesiumia. Kuinka monta kilogrammaa titaania voidaan saada?
"Niin, rakas Watson", sanoi Sherlock Holmes, "osoitamme, että murha oli tehty juottamalla uhrille arsenikkia kahvin kanssa. Suoritamme huolellisesti Betterdorffin kokeen todetaksemme kahvijäännöksessä olevan arseenia. Sekoitamme kahvinäytteen väkevään suolahappoon liuotetun tina(II)kloridin kanssa, lämmitämme varovasti kaasuliekillä ja voimme todeta… aha! … aivan oikein, liuos värjäytyy ruskeaksi, muodostuu vapaata arseenia!" Reaktio on:
| a) | Määritä reaktioyhtälön kertoimet. (2 p.) |
| b) | Mitkä aineet hapettuvat ja mitkä pelkistyvät reaktiossa? Esitä myös vastaavat hapetuslukujen muutokset. (2 p.) |
| c) | Laadi reaktioyhtälö, kun liuoksessa oleva arseeni esiintyy arseenitrioksidina (As2O3). Lisää tarvittaessa yhtälöön vetyioneja ja vettä. (2 p.) |
Alkoholijuoma sisältää vain etanolia ja vettä. Seosta analysoitaessa etanoli hapetetaan hiilidioksidiksi reaktion
mukaisesti. Samalla juomassa oleva vesi höyrystyy ja se kerätään yhdessä reaktiossa muodostuneen veden kanssa. Mikä oli juoman alkoholipitoisuus massaprosentteina, kun siitä otetusta 10,00 gramman näytteestä saatiin 10,77 g vettä?
Mitä tarkoitetaan atomin ionisoitumisenergialla?

Oheisessa kuvassa on esitetty ensimmäisen ionisoitumisenergian arvo (kJ/mol) eri alkuaineille. Miten kuvassa näkyviä muutoksia voidaan perustella, ja mitä johtopäätöksiä tällä perusteella voidaan tehdä atomien elektronirakenteista?
Selosta, miten seuraavat yhdistetyypit eroavat rakenteeltaan toisistaan. Esitä myös jokin kemiallinen tai fysikaalinen ominaisuus, jossa ero ilmenee.
a) alkeeni ja aromaattinen hiilivety, (2
p.)
b) aromaattinen alkoholi ja fenoli, (2 p.)
c)
tärkkelys ja selluloosa. (2 p.)
Tarkastele oheisen kuvan mukaisia koejärjestelyjä.
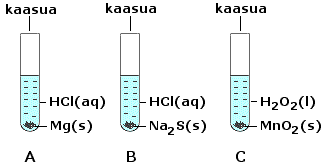
a) Mitä kaasua koeputkissa A, B ja C vapautuu?
(2 p.)
b) Laadi kussakin koeputkessa tapahtuvan reaktion
yhtälö. (4 p.)
15 millilitraan 0,0010 M hopeanitraattiliuosta
lisättiin 15 ml 0,0010 M natriumkloridiliuosta.
a) Osoita,
että astiaan saostuu hopeakloridia. (2 p.)
b) Laske hopeaionin
konsentraatio liuoksessa, kun tasapaino on asettunut. (4 p.) Hopeakloridin
liukoisuustulo on KL(AgCl) = 1,8 ·
10–10 (mol/l)2.
Säilönnässä ja mausteena käytettävä väkiviinaetikka on koostumukseltaan laimeaa etikkahappoliuosta. Etikkahapon tarkan pitoisuuden määrittämiseksi väkiviinaetikasta otettiin 25,0 ml:n näyte, joka titrattiin 0,194 M NaOH-liuoksella. Ennen titrauksen aloittamista näyte laimennettiin vedellä noin 100 millilitraksi. Titraukset on koottu alla olevaan taulukkoon:
| V(NaOH)/ml | 0 | 1,0 | 2,0 | 4,0 | 6,0 | 7,0 | 8,0 | 8,5 | 10,0 | 14,0 |
| pH | 2,9 | 4,0 | 4,3 | 4,7 | 5,2 | 5,5 | 6,4 | 11,2 | 12,0 | 12,4 |
| a) | Piirrä titrauskäyrä. Käytä pystyakselina liuoksen pH:ta ja vaaka-akselina NaOH-kulutusta. Merkitse ekvivalenttikohdan sijainti kuvaan ja määritä sen perusteella etikkahapon pitoisuus (g/l) väkiviinaetikassa. (3 p.) |
| b) | Miksi laimennuksessa saadun liuoksen tarkkaa tilavuutta ei tarvitse tietää? (1 p.) |
| c) | Titrauksen päätepiste voidaan todeta myös happo-emäsindikaattoria käyttäen. Mitä seikkoja tulee indikaattoria käytettäessä ottaa huomioon? Ehdota jotain titraukseen sopivaa indikaattoria. (2 p.) |
Optisesti aktiivisen yhdisteen C5H10O (= A) rakenteessa on yksi karbonyyliryhmä. A pelkistyy helposti, jolloin saadaan yhdiste C5H12O (= B). A voidaan hapettaa yhdisteeksi C5H10O2 (= C). Kun B ja C reagoivat keskenään, syntyy yhdiste D ja vettä. Laadi yhdisteiden A, B, C ja D rakennekaavat.
Ravinnon rasvat koostuvat suurelta osin triglyserideistä, jotka muodostuvat, kun kolmenarvoinen alkoholi glyseroli reagoi kolmen rasvahappomolekyylin kanssa.
Rasvahapot voivat olla tyydyttyneitä tai niiden rakenteissa on yksi tai useampi kaksoissidos. Hiiliketju on haaroittumaton ja sisältää tavallisesti 12-18 hiiliatomia. Seuraavassa taulukossa on kuvattu muutamia tärkeitä ravinnosta saatavia rasvahappoja ja niiden esiintymistä ravinnossa.
| Nimi | Symboli* | Esiintyminen |
| Palmitiinihappo | C16:0 | maito- ja lihavalmisteet, voi |
| Steariinihappo | C18:0 | maito- ja lihavalmisteet, voi |
| Öljyhappo | C18:1n-9 | rypsi- ja oliiviöljy |
| Linolihappo | C18:2n-6 | auringonkukka-, maissi-, soija- ja rypsiöljy |
* C:n perässä oleva luku tarkoittaa rasvahapossa olevien hiiliatomien määrää. Kaksoispisteen jälkeen oleva numero osoittaa kaksoissidosten lukumäärän. Numero n-kirjaimen jälkeen kertoo ensimmäisen kaksoissidoksen paikan, eli n-9 tarkoittaa, että kaksoissidos lähtee rasvahappomolekyylien metyylipäästä laskien yhdeksännestä hiilestä.
| a) | Kirjoita rakennekaavoin triglyseridin muodostumisreaktio, kun glyseroli reagoi kolmen öljyhappomolekyylin kanssa. Öljyhapon kaksoissidos on cis-sidos. (2 p.) |
| b) | Kun eläinrasvaa hydrolysoidaan NaOH-liuoksella, saadaan saippuaa. Esitä reaktiotuote, kun triglyseridi, jossa happo-osana on palmitiinihappo, hydrolysoidaan NaOH-liuoksella. (2 p.) |
| c) | Margariinia valmistettaessa osa cis-rasvahapoista pelkistyy tyydyttyneiksi rasvahapoiksi ja osa muuttuu trans-rasvahapoiksi, joita margariinissa on muutama prosentti. Eräässä linolihapon isomeereista ensimmäinen kaksoissidos metyylipäästä lukien on cis-sidos ja toinen, kahdeksannesta hiilestä lähtevä kaksoissidos on trans-sidos. Laadi tämän linolihapon rakennekaava ja happoa pelkistettäessä saadun tyydyttyneen rasvahapon rakennekaava. (2 p.) |
| d) | Ravintorasvojen tyydyttymättömyysastetta kuvataan
jodiluvulla, jolla tarkoitetaan jodin määrää grammoina
100:aa rasvagrammaa kohti. Se määritetään antamalla
rasvahapon kaksoissidosten reagoida jodin kanssa:
 I2(s) + 2
Na2S2O3(aq) →
Na2S4O5(aq) + 2 NaI(aq) Maissiöljyn
jodiluvun määrityksessä lähtöaineina käytettiin
43,8 g jodia ja 35,3 g öljyä. Laske jodiluku, kun reagoimattoman
jodin titraukseen kului 20,6 ml 0,142 M natriumtiosulfaattiliuosta. (3 p.)
|

Polttokennon periaate keksittiin jo vuonna 1938, mutta laajamittainen tutkimus- ja kehitystyö alkoi vasta 1980-luvulla. Kioton ilmastosopimus on omalta osaltaan lisännyt eri maiden tutkijoiden ja teollisuuden kiinnostusta polttokennojen kehittämistä kohtaan.
a) Mitä polttokennolla tarkoitetaan, ja miksi sen avulla tuotettu sähkö- ja lämpöenergia on ympäristön kannalta parempi vaihtoehto kuin perinteisin menetelmin tuotettu? (4 p.)
b) Oheisessa kaaviossa on esitetty erään polttokennon rakenne. Selosta, miten kuvan polttokenno toimii ja mitä reaktioita sen toiminnan aikana tapahtuu. (5 p.)