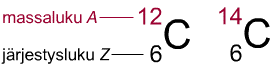KEMIAN SIVUT
Kemian ylioppilastehtävien ratkaisut, kevät 2005
1 | 2 | 3 |
4 | 5 | 6 | 7 | +8 |
kysymykset (erilliseen
selainikkunaan)
Tehtävän käsitteet on helppo tarkistaa
oppikirjoista, mutta ohessa ehdotuksia vastaukseksi.
a) Alkuaine on täsmällisimmin
määriteltävissä atomin rakenteen perusteella: alkuaineen
kaikilla atomeilla on sama järjestysluku Z ts. niiden
ytimessä on sama määrä protoneja. (Joskus alkuainetta on
ollut tapana kuvata myös siten, että se on aine, jota ei kemiallisin
keinoin pystytä jakamaan pienempiin osiin.)
Esimerkki
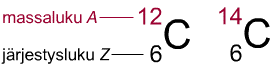 |
Kuvassa on kahden hiilen isotoopin C-12 ja C-14
merkintä, josta käy ilmi niiden ero. Molemmilla isotoopeilla on
ytimessään 6 protonia, mutta niiden massaluku on erilainen, koska
ytimissä on eri määrä neutroneja. C-12 -isotoopilla on 12
– 6 = 6 neutronia, kun taas C-14-isotoopilla on 14 – 6 =8
neutronia. |
b) Isotoopit ovat saman alkuaineen erimassaisia
atomeja. Useimmilla alkuaineilla on erilaisia isotooppeja. Luonnosta
eristetyt alkuaineet ovat yleensä isotooppiensa seoksia.
c) Ioni on yhdestä tai useammasta atomista
muodostunut hiukkanen, jolla on sähkövaraus. Sähkövaraus on
negatiivinen, jos ioni on muodostuessaan saanut yhden tai useamman elektronin.
Ionin varaus on positiivinen, mikäli ioni on syntyessään
menettänyt elektroneja. Metallit muodostavat helposti positiivisia ioneja,
koska niiden uloimmalla elektronikuorella on vähän elektroneja, jotka
irtoavat helposti. Ioniin jää tällöin uloimmaksi
elektronikuoreksi edellinen täysi (oktetti!) kuori. Epämetalleille
tyypillisiä ovat puolestaan negatiiviset ionit, koska epämetallien
uloimmalla kuorella on runsaasti elektroneja: täydestä
miehityksestä (tai oktetista) puuttuu vain 1 – 3 elektronia. Ionin
varaus määräytyy yhtä ionia kohti saatujen tai
luovutettujen elektronien lukumäärän mukaan.
Esimerkki
Natriumatomista tulee
Na+-ioni, kun atomin uloimmalta kuorelta irtoaa yksi elektroni.
Kalsium atomista irtoaa helposti kaksi elektronia uloimmalta kuorelta, joten
tuloksena on Ca2+-ioni. Oksoniumioni H3O+ on
kompleksi-ioni, joka syntyy vesimolekyylin poimiessa mukaansa yhden protonin
H+.
Kloridi-ioni Cl— muodostuu klooriatomin saadessa
uloimmalle kuorelleen yhden elektronin lisää entisten seitsemän
lisäksi. Sulfaatti-ioni SO42– on koostunut
rikkiatomista ja neljästä happiatomista, mutta kooste potee kahden
elektronin vajausta.
d) Elektrolyytti on ioneista koostuva aine, joka
johtaa sähköä joko sulatteena tai vesiliuoksena.
Sähkönjohtavuus perustuu siihen, että sulatteessa ja liuoksessa
ionit pääsevät liikkumaan melko vapaasti. Tyypillisiä
elektrolyyttejä ovat suolat, sekä hapot ja emäkset. Happojen ja
emästen vesiliuoksissa on ioneja protolyysireaktion seurauksena.
Esimerkki
NaCl on suola, joka koostuu
Na+- ja Cl–-ioneista. Suolahappo eli HCl(aq) on
elektrolyytti, jonka vesiliuoksessa tapahtuu protolyysi:
HCl + H
2O

H
3O
+ + Cl
–e) Liuos on homogeeninen seos (yleensä
nestemäinen). Aidossa liuoksessa hiukkaset ovat niin pieniä, ettei
niitä pysty näkemään edes mikroskoopilla, joten liuos
(neste) näyttää läpikuultavalta ja kirkkaalta. Liuoksiksi
sanotaan myös kolloidikokoisia hiukkasia sisältäviä
nestemäisiä seoksia, jotka voivat näyttää paljaalle
silmälle kirkkailta (kahvi) tai hieman valoa hajottavilta
(saippualiuokset).
Esimerkki
NaCl on kiteinen suola, joka liukenee
melko suurina määrinä veteen. Tuloksena on kirkas neste, jossa
on ioneja. NaCl on liuennut aine ja vesi liuotin. Sokeri on molekyyliyhdiste,
joka liukenee myös hyvin veteen. Sokerin kidehila purkautuu molekyyleiksi
vedessä. Sokerin vesiliuos sisältää siten sokeri- ja
vesimolekyylejä. Sokeri on liuennut aine ja vesi liuotin.
Myös nesteet voivat liueta toisiinsa: vesi ja etanoli muodostavat
liuoksia, joissa kumpi tahansa aineista voi olla liuotin. Liuotin on kulloinkin
se aine, jota liuoksessa on enemmän.
Kaasutkin muodostavat nesteiden kanssa liuoksia.
Hyvin suurimolekyyliset yhdisteet, kuten proteiinit, muodostavat
useimmiten kolloidisia liuoksia.
f) Liuotin on aine, joka muodostaa edellisessä
kohdassa mainittuja liuoksia siten, että on niissä
pääkomponenttina. Ylivoimaisesti yleisin liuotin on vesi, joka
liuottaa sekä suoloja että molekyyliyhdisteitä. Tavallisia
orgaanisia liuottimia ovat dietyylieetteri
H3CH2–O–CH2CH3, etanoli
H3CH2OH ja dikloorieteeni CH2Cl2.
Myös bensiiniä nimitetään joskus liuottimeksi, vaikka se
itse asiassa on jo itse liuos: se sisältää useita erilaisia
C8-sarjan hiilivetyjä ja joitakin aromaattisia
hiilivetyjä.
a) Tasapainotettu reaktioyhtälö:
2 NaI(aq)
+ 2 H2SO4(aq) + MnO2(s)
→ Na2SO4(aq) +
MnSO4(aq) + I2(s) + 2
H2O(l)
M(NaI) =
149,89 g/mol
M(MnO2) = 86,84
g/mol
M(I2) = 253,81 g/mol
n =
cV
n = m : M
b) Lasketaan aluksi NaI:n ja MnO2:n
ainemäärät, jotta saadaan selville kumman aineen
määrä rajoittaa tuotteen muodostumista.
n(NaI) = 0,50
M · 150 ml =75,0 mmol
n(MnO2) = 2,9 g
: 86,94 g/mol = 0,033356 mol = 33,356 mmol
Reaktioyhtälön
mukaan n(NaI) = 2 · n(MnO2)
2
· 33,356 mmol = 66,712 mmol < 75,0 mmol
Tuotteena syntyvän jodin määrä lasketaan siten
mangaanidioksidin ainemäärän
perusteella:
n(I2) = n(MnO2)
m(I2) = 0,033356 mol · 253,81 g/mol =
8,5 g
c) Reaktiossa käytetään hapettavana reagenssina
mangaanidioksidia MnO2, johon hapetusasteella +4 sisältyvä
mangaani-ioni toimii varsinaisena hapettimena pelkistyen +2:n arvoiseksi
(vastaanottaa 2 elektronia/ ioni). NaI:n -1:n arvoinen jodidi-ioni toimii
pelkistimenä (luovuttaa elektronin/ioni) jodidin hapettuessa
alkuainejodiksi I2, jonka hapetusaste on 0.
Yhdisteryhmät ovat:
1 primaarinen
amiini
2 aromaattinen yhdiste
3 esteri
4
tertiaarinen amiini |
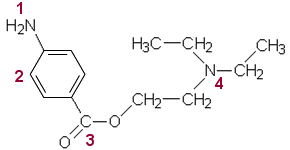 |
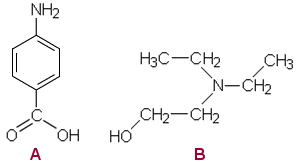
Prokaiinia hydrolysoitaessa esteri purkautuu ja syntyvät tuotteet
A ja B.
a) Oikein
b) Oikein
c)
Väärin
Liuoksen pH on yli 7. Jos titrauksesta on
tallennettu titrauskäyrä, käyrältä voidaan saada
yksiarvoisen hapon pKa-arvo pisteestä, jossa puolet
haposta on neutraloitu, koska liuoksen pH = pKa +
lg([suola]/[happo] ja tällöin konsentraatiot [suola] ja [happo] ovat
yhtä suuret.
d) Väärin
Liuoksen pH on
jonkin verran emäksisellä puolelle, koska titrataan heikkoa happoa
vahvalla emäksellä.
e) Väärin.
Liuos
ei ole puskuriliuos, koska happo on neutraloitu (liuos on tällöin
vain lievästi emäksinen suolaliuos). Ekvivalenttikohdassa pH-muutos
on jyrkkä pienenkin emäs- ja happolisäyksen vaikutuksesta. Huom.
titrauskäyrässä ekvivalenttikohdalla on
hyppäys.
f) Väärin
Natrium- ja
hydroksidi-ionin konsentraatiot poikkeavat toisistaan, koska hydroksidi-ionien
valtaosa on reagoinut oksoniumionien kanssa tuottaen vettä, mutta
liuokseen tulleet natriumionit ovat reagoimattomina tallella
liuoksessa.
Neutraloituminen kuluttaa hydroksidi-ioneja:
OH
– +
H
3O
+

2 H
2O
a) Puhtaassa vedessä tapahtuu molekyylien
törmäysten seurauksena hyvin vähäisessä
määrin vesimolekyylien hajoamista ioneiksi eli veden
autoprotolyysiä
2 H
2O

OH
– + H
3O
+Hydroksidi- ja oksoniumionien konsentraatioiden tuloa
Kw =
[OH– ][H3O+] nimitetään
veden ionituloksi. Se voidaan tulkita edellä esitetyn reaktion
tasapainovakion lausekkeeksi, josta hajoamatta jääneen veden
konsentraatio on jätetty pois.
b) 40 °C:ssa Kw = 2,9 ·
10–14(mol/l)2
[H3O+] =
[OH– ] = (2,9 ·
10–14mol2/l2)0,5 = 1,702
· 10–7 mol/l
log 1,702 ·
10–7 = – 6,77
pH = 6,8.
c) pH + pOH = pKw
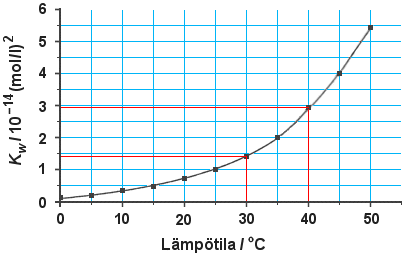
30 °C:ssa
Kw = 1,45 ·
10–14(mol/l)2
pKw = –log
1,45 · 10–14 = 13,84
pOH = 13,84 – 4,52
= 9,32
c(OH–) = 10–9,32 mol/l = 4,79
· 10–10 mol/l eli 4,8 ·
10–10 mol/l
Jos käyrältä luetaan arvoksi:
Kw = 1,5 ·
10–14(mol/l)2, c(OH–) :ksi
saadaan 5,0 · 10–10 mol/l
d) Autoprotolyysi on endoterminen reaktio, koska
lämpötilan kohotessa vesimolekyylejä hajoaa enemmän
(ionitulon arvo kasvaa lämpötilan noustessa).
a) Oletetaan 100 g:n näyte ja lsketaan
alkuaineiden ainemäärät.
| |
C |
H |
| % |
92,2 |
7,8 |
| m (g) |
92,2 |
7,8 |
| M g/mol |
12,01 |
1,01 |
| n(mol) |
7,68 |
7,72 |
| suhdeluku |
1 |
1 |
Koska ainemäärien suhde: n(C) : n (H) = 1
: 1, yhdisteen suhdekaava on k(CH).
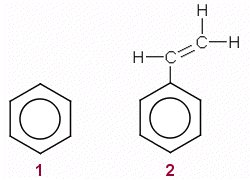
Mahdollisia ehdokkaita ovat
bentseeni:M(C6H6) = 78 g/mol << 110
g/mol
styreeni: M(C8H8) = 104 g/mol < 110
g/mol
Näistä styreenin moolimassa on lähempänä
annettua moolimassaa 110 g/mol, mutta betseeniäkään ei voida
sulkea pois.
b) ja c) Nimet ja rakennekaavat, bentseeni
(1) ja styreeni (2)
Styreenin muita vastauksessa
hyväksyttäviä nimiä:
vinyylibentseeni,
etenyylibentseeni, fenyylieteeni.
Reaktioyhtälö
2 H
2O
2(aq)

O
2(g) + 2 H
2O(l)
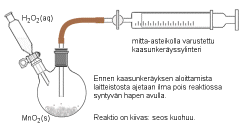
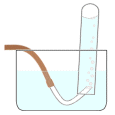
Vetyperoksidi hajoaa reaktiossa hapeksi ja vedeksi. Kaasu voidaan johtaa
reaktioastiasta esim. letkua pitkin kaasunmittausylinteriin tai vesimaljaan
alassuin asetettuun koeputkeen (tai mitta-asteikolla varustettuun
lasisylinteriin tai pulloon) tai tyhjään ilmapallon kuoreen.
Ilmapallon kuorta käytettäessä kaasun tilavuuden mittaus voi
olla hankalaa, mutta kaasunmittaussylinteriin on kyllä mahdollista ottaa
näyte pallosta.
Muitakin ratkaisuja hyväksyttiin.
Kaasun
keräysastiaksi vältetään yleensä
käyttämästä tasapohjaista lasiastiaa, mutta vastauksessa
tasapohjainen pullo kuitenkin hyväksyttiin.
 |
 |
 |
| Kutakin kuvaa
näpäyttämällä saat suuremman piirroksen
näkyviin. |
Kaasu voidaan todeta hapeksi viemällä hehkuva puutikku
keräysastian suulle. Koska astian suulla hapen määrä on
suurempi kuin huoneilmassa, tikku leimahtaa liekkiin.
M(O2) = 32,00
g/mol
Mitattu tilavuus V
Ideaalikaasun moolitilavuus
Vm
n = V :
Vm
m = nM
Kaasun massan selvittämiseksi kerätään
määrätilavuus kaasua.
m(O2) = 32,00 g/mol · V :
V m
Mikäli kaasun tilavuus halutaan
määrittää tarkasti, on otettava huomioon huoneen
lämpötila ja vallitseva ilmanpaine. Tällöin laskelmissa
turvaudutaan ideaalikaasun tilanyhtälöön
pV = nRT.
Työturvallisuus
Liekkiä käsiteltäessä
on varottava sytyttämästä muuta kuin testitikku. Riski riippuu
tietysti hapen määrästä. Työ on paras tehdä
vetokaapissa. Silmät on syytä suojata. Vetyperoksidi (jos
käytetään väkeviä liuoksia) on
syövyttävää. Myös kädet siis suojataan.
Sitaatti MAOL ry:n pistesuosituksesta kemian
reaalikokeen tehtäviin keväällä 2005:
| Selitetty dispersiovoimien ja dipoli-dipolisidoksen
muodostuminen sekä erikoistapauksena vetysidos. |
2 – 3 p |
| Selitetty esimerkein sidoksen vaikutus sulamis- ja
kiehumispisteeseen sekä liuokoisuuteen. |
3 – 4 p |
| Tarkasteltu muita ominaisuuksia sidosten kannalta,
esimerkiksi vetysidoksen merkitys veden ja biokemiallisten yhdisteiden
ominaisuuksissa. |
2 – 3 p |
| yhteensä |
9 p |
| Korkeammat pistemäärät
edellyttävät kemiallisesti kypsää, hyvin
jäsenneltyä aiheen käsittelyä ja riittävän
monipuolisten esimerkkien käyttämistä. |
|
Vertaa yo96k.html
tehtävä 1.