
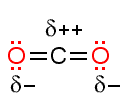

1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
Molekyyleillä on sekä hetkellisiä että pysyviä dipoliominaisuuksia. Hetkelliset dipoliominaisuudet johtuvat elektronien liikkeestä.
Hetkelliset dipolit aiheuttavat muuten poolittomien molekyylien välille vetovoimia, jotka ovat sitä suurempia, mitä enemmän molekyylissä on elektroneja. Myös molekyylin pinnan laajuus vaikuttaa näiden voimien suuruuteen. Tällaisia voimia sanotaan dispersiovoimiksi (van der Waalsin sidoksiksi). Nämä vuorovaikutukset eivät ole kovin voimakkaista, mistä johtuu se, että poolittomien molekyyliyhdisteiden sulamis- ja kiehumispisteet ovat yleensä matalia. Alkaanisarjan fysikaalisten ominaisuuksien säännöllinen muuttuminen kuvastaa hyvin dispersiovoimien ja molekyylikoon välistä suhdetta: suuret suoraketjuiset molekyylit vaativat korkeamman lämpötilan sulaakseen ja kiehuakseen kuin pienimolekyyliset. Elektronimäärän vaikutus näkyy myös halogeenisarjassa. F2, Cl2 ovat kaasuja, Br2 on neste ja I2 on kiinteä aine huoneenlämpötilassa.
Pysyviä dipoleja syntyy molekyyleihin, jotka ovat muodostuneet elektronegatiivisuudeltaan erilaisista atomeista eivätkä ole rakenteeltaan siten symmetrisiä, että varausjakauma kumoutuisi. Esimerkiksi H2O ja HCl ovat tällaisia molekyylejä, mutta CO2 ei ole.

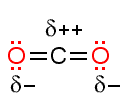

Pysyvien dipolien väliset vuorovaikutukset ovat dispersiovoimia vahvempia ja sen seurauksena yhdisteiden sulamis- ja kiehumispisteet ovat korkeampia kuin poolittomilla vastaavankokoisista molekyyleistä muodostuneilla yhdisteillä. Mikäli molekyylissä on vetyä ja happea tai fluoria, voi muodostua myös ns. vetysidoksia. Juuri vetysidosten osuudella selitetään veden korkea sulamis- ja kiehumispiste, 0 °C ja 100 °C. Vertailukohtana mainittakoon, että esimerkiksi metaanin CH4 sulamispiste on –184 °C ja kiehumispiste –161 °C. Vetysidosten vaikutus näkyy selvästi myös vertailtaessa alkaanien ja alkoholien kiehumispisteitä.
| Yhdiste | kp °C |
|---|---|
| Metanoli CH3OH | 65 |
| Etaani C2H6 | –89 |
| Etanoli C2H5OH | 79 |
| Propaani C3H8 | –45 |
Dipoliominaisuudet ja vetysidokset vaikuttavat myös aineiden
liukoisuuteen. Esimerkiksi vesi liuottaa hyvin toisia poolisia
yhdisteitä kuten vetykloridia HCl ja alkoholeja, mutta huonosti mm.
dietyylieetteriä C2H5OC2H5,
joka kyllä liukenee heikommin pooliseen etanoliin. Hiilivedyt (kuten
bensiini) puolestaan liuottavat hyvin toisia poolittomia yhdisteitä mm.
rasvoja.
Vrt. Yo 98 k tehtävä
1
Tässä mainituista yhdisteistä pooliton CO2 on erikoinen: se ei nesteydy ollenkaan normaalipaineessa, mutta muuttuu kiinteäksi –79 °C:n lämpötilassa. Korkeassa paineessa se voidaan kuitenkin nesteyttää ja näin saatua nestettä käyttää alhaisessa lämpötilassa tapahtuvaan poolittomien aineiden (aromiaineet yms.) uuttamiseen.
Reaktioyhtälöt
Lavennetaan ensimmäinen yhtälö neljällä, lasketaan yhtälöt yhteen ja jaetaan tulos vielä 3:lla, jolloin saadaan
Tämän perusteella n(O2) = 4
n(S8) = 4 · m(S8) :
M(S8).
V(O2) = n(O2)
· Vm = 4 · 3,87 g : (8
· 32,07g/mol) · 22,4 dm3/mol = 1,35
dm3
Reaktioyhtälön kerrointen määritys yksityiskohtaisemmin (omaan ikkunaansa)
a) NH4+-ionissa N:n
hapettumisluvuksi x saadaan:
x + 4 · (+1) = +1
eli x = –3
NO3–-ionissa N:n
hapettumisluvuksi y saadaan: y + 3 · (–2) = –1
eli y = +5
N2O:ssa N:n hapettumisluku z on: 2z +
(–2) = 0 eli z = +1
Hapen ja vedyn hapettumisluku pysyy ennallaan reaktiossa, mutta molempien N-atomien hapettumisluku muuttuu +1:ksi. Niinpä ammoniumionin typpi hapettuu (–3 → +1, luku kasvaa) ja nitraatti-ionin typpi pelkistyy (+5 → +1, luku pienenee).
b) Koska N2O-molekyyli on lineaarinen ja poolinen, sen rakenteen täytyy olla NNO. Rakenne NON olisi symmetrisenä ja lineaarisena pooliton.
c) Kaasun tiheys lasketaan moolimassan perusteella: moolimassa
jaetaan ideaalikaasun moolitilavuudella. Niinpä dityppimonoksidi on ilmaa
raskaampaa, koska ilman keskimääräinen moolimassa on pienempi
kuin dityppioksidin moolimassa:
M(ilma) = 0,21 · 32
g/mol + 0,78 · 28 g/mol = 29 g/mol
M(N2O)
= 2 · 14,01 g/mol + 16,00 g/mol = 44 g/mol.
tiheys:
ρ(N2O) = 44,02 g/mol : 22,4 dm3 = 1,96
g/dm3
a) Kylläisessä liuoksessa on aina sekä kiinteä faasi että liuosfaasi. Dynaamisella tasapainolla tarkoitetaan tässä tapauksessa sitä, että ainetta siirtyy koko ajan ja yhtä suuri määrä kiinteästä faasista liuokseen ja takaisin.
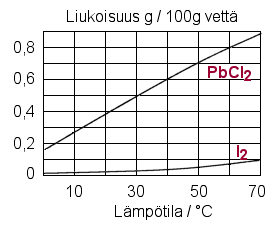
b) Kaaviosta nähdään, että jodia liukenee
samassa lämpötilassa veteen vähemmän kuin
Lyijy(II)kloridin liukoisuus kasvaa lämpötilan kohotessa selvemmin kuin jodin.
c) Ei liukene. Lyijy(II)kloridia liukenee 20 °C:ssa 0,3 g/100 g vettä, 50 ml:aan vettä liukenee siten vain 0,15 g lyijy(II)kloridia.
d) Koska jodin liukoisuus kasvaa hieman lämpötilan kohotessa, liukeneminen sitoo lämpöä. Liuos siis periaatteessa jäähtyy, mutta erittäin vähän, tuskin havaittavasti.
e) Lyijykloridin liukoisuus veteen 50 °C:n lämpötilassa on 0,7 g / 100 g .
Liuokoisuustulo
on
[Pb2+][Cl– ]2 = 2,517
· 10–2 M · (2,517 ·
10–2 M)2 = 6,4 · 10–5
mol3 l –3
(tai 6,4 ·
10–5 mol3dm–9)
a) Lasketaan aluksi yhdisteen alkuaineiden ainemääräsuhteet prosenttisen koostumuksen perusteella. Ajatellaan, että prosenttiosuudet vastaavat alkuaineen massaa 100 g:n näytteessä.
| Aine | Osuus | m g | M g/mol | n mol |
| C | 36,1 % | 36,1 | 12,01 | 3,0 |
| H | 5,3 % | 5,3 | 1,008 | 5,3 |
| N | 10,5 % | 10,5 | 14,01 | 0,75 |
| O | 48,1 % | 48,1 | 16,00 | 3,0 |
Alkuaineiden ainemäärien suhde C : H : N :
O = 3,0 : 5,3 : 0,75 : 3,0
Sievennetään
jakamalla 0,75 :llä: 4 : 7 : 1 : 4
Empiirinen
kaava (C4H7NO4)k
Arvolla
k = 1, M(C4H7NO4) = 133 g/mol,
mittaustulos on 129 –135 g/mol
Molekyylikaava
C4H7NO4
b) Aminohapon mahdolliset rakennekaavat
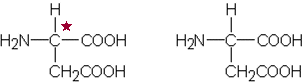
c) Vasemmanpuoleinen kaava esittää optisesti aktiivista yhdistettä. Asymmetrinen hiiliatomi on merkitty tähdellä kaavaan.
a) Pyridiini on heikko emäs, jonka protolyysireaktio vedessä on seuraava:
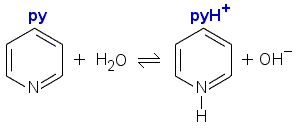
Merkitään valmistettavan liuoksen pyridiinin konsentraatiota x:llä.
| Aine | Konsentraatio tasapainossa |
| py | x – 10–5,30 mol/l |
| pyH+ | 10 –5,30 mol/l |
| OH– | 10 –5,30 mol/l |
Emäsvakion lausekkeesta
saadaan:
Kb = [OH– ] ·
[pyH+] : [ py]
Kb =
(10–5,30 mol/l) 2 : (
x – 10–5,30 mol/l) = 1,5 ·
10–9 mol/l
Ratkaisuksi saadaan x = 1,674
· 10–2 mol/l
Yhtälö
ja ratkaiseminen kuvana
n(py) = 0,10 l · 1,674
· 10–2 mol/l = 1,674 ·
10–3 mol
m(py) = n(py) ·
M(py) = 0,13 g
b) Kun pyridiini reagoi typpihapon kanssa syntyy pyridiniumnitraattia pyH+ NO3–. Pyridiniumnitraatin vesiliuos on hapan, koska pyridimiumnitraatti on vahvan hapon (typpihappo) ja heikon emäksen (pyridiini) suola. Vesiliuoksessa tapahtuvat reaktiot:
| liukeneminen: | pyH+ NO3–
|
| hydrolyysi: | pyH + H2O
|
Vetykloridi on vahva happo, joten sen konsentraatio voidaan määrittää tarkasti titraamalla vahvalla emäksellä, ts. tunnetun väkevyisellä NaOH-liuoksella.
Aluksi kannattaa mitata liuoksen happamuus vaikkapa pH-paperilla. Sen perusteella arvioidaan, kuinka suuri näyte titrataan ja minkä väkevyistä NaOH-liuosta käytetään. Esimerkiksi jos pH on noin 1, c(HCl) on likimain 10-1 mol/l eli 0,1 mol/l. Näytteen suuruus voi olla 15 - 25 ml, jos käytetään 50 ml:n byrettiä. NaOH-kulutuksen tulisi tällöin olla vähintään 10 ml, jotta määrityksen tarkkuus olisi hyvä.
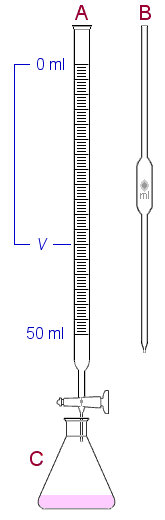
Titrauksen suoritus
Byretti (A) täytetään NaOH-liuoksella.
Näyte mitataan tarkasti täyspipetillä (B) pulloon (C),
johon lisätään myös muutama pisara indikaattoria
(fenoliftaleiini, titrataan aavistuksen verran punertavaksi).Titrauksen
kuluessa pulloa sekoitetaan koko ajan ja tarvittaessa huuhdotaan pullon
seinämät tislatulla vedellä (pienellä
määrällä). Titraus kannattaa toistaa pari kolme kertaa ja
laskea saaduista NaOH-kulutuksista keskiarvo. Titrauksen tarkkuus riippuu
HCl-liuoksen väkevyydestä. Väkevämmästä
liuoksesta saadaan parempi titrauskäyrä. Ekvivalenttikohdan
määritykseen voidaan käyttää indikaattorin asemesta
pH-mittaria. Titrauskäyrä on tällöin mahdollista tallentaa.
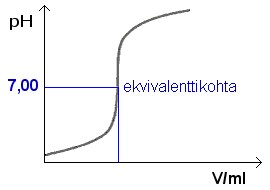
Huomaa, että vahva happoa vahvalla emäksellä (tai päinvastoin) titrattaessa loppukohdan pH = 7,00.
Vrt. Yo 97 k Tehtävä +8 ja yo 97 s tehtävä 7
Vetykloridin konsentraatio on mahdollista määrittää myös saostamalla kloridi-ionit hopeanitraatilla AgNO3.
Seuraavia asioita olisi tarpeen sisällyttää vastaukseen hiilihydraateista: