| happo 1 | emäs 2 | happo 2 | emäs 1 | |||
| HCl | + | H2O | H3O+ | + | Cl– | |
| emäs 1 | happo 2 | happo 1 | emäs 2 | |||
| NH3 | + | H2O | NH4+ | + | OH– |
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Emäksinen vesiliuos
Vesiliuos on
emäksinen silloin, kun sen pH on yli 7. Liuoksen pH voidaan mitata
pH-mittarilla tai indikaattoripaperilla. Esimerkiksi yleisindikaattoripaperi
muuttuu siniseksi emäksisen liuoksen vaikutuksesta. emäksiyys voidaan
todetta myös indikaattoriliuoksella: mm. fenoliftaleiiniliuos saa punaisen
värin emäksisissä olosuhteissa. Laboratorioissa tavallisia
emäksisiä liuoksia ovat natrium-, kalium- ja
kalsiumhydroksidiliuokset NaOH(aq), KOH(aq) ja Ca(OH)2(aq) sekä
ammoniakin vesiliuos NH3(aq). Emäksiset vesiliuokset
sisältävät enemmän hydroksidi-ioneja (OH–)
kuin oksoniumioneja (H3O+).
Jokapäiväisestä elämästä tuttuja emäksisiä liuoksia ovat pesuaine- ja saippualiuokset. Emäksiset liuokset tuntuvat käteen liukkailta, koska ne hydrolysoivat ihon pinnasta rasvaa. Vahvasti emäksiset liuokset ovat syövyttäviä eikä niitä saa päästää iholle.
b) Heikko emäs
Emästä sanotaan heikoksi
silloin, kun se ei protolysosidu täydellisesti vesiliuoksessa. Esimerkiksi
ammoniakki NH3 on heikko emäs, joka protolysoituu osittain
(kts. tehtävä 3c)
c) Emäksinen oksidi
Kun
oksidi liukenee veteen (reagoi veden kanssa!) tuottaen emäksisen liuoksen,
sanotaan oksidia emäksiseksi. Esimerkiksi Na2O
(dinatriumoksidi) ja CaO (kalsiumoksidi, "poltettu kalkki") ovat
emäksisiä oksideja.
| Na2O(s) + H2O(l) → 2 NaOH(aq) |
| CaO + H2O(l) → Ca(OH)2(aq) |
Alkali- ja maa-alkalimetallien oksidit ovat selvästi emäksisiä (mistä metallien ryhmänimi johtuukin).
d) Liuoksen pOH
Liuoksen happamuus tai emäksisyys
ilmoitetaan useimmiten pH-arvolla, joka saadaan liuoksen
oksoniumionikonsentraation logaritmista jättämällä pois
negatiivinen etumerkki. Vastaavasti liuoksen hydroksidi-ionikonsentraation
logaritmista saadaan liuoksen pOH, joka siis on -log[OH–].
Esimerkki
Jos NaOH-liuoksen konsentraatio on 0,001 mol/l, sen pOH
on 3, koska [OH–] = 0,001 mol/l = 10–3 mol/l.
Liuoksen pH on 14 – 3 =11. Liuos on siis selvästi emäksinen.
Veden ionitulon perusteella pH + pOH = 14.
e) Amfolyytti
Aine, joka voi toimia
Brønsted-happona sekä emäksenä, on amfolyytti.
Esimerkiksi vesi on amafolyytti.
| happo 1 | emäs 2 | happo 2 | emäs 1 | |||
| HCl | + | H2O | H3O+ | + | Cl– | |
| emäs 1 | happo 2 | happo 1 | emäs 2 | |||
| NH3 | + | H2O | NH4+ | + | OH– |
Moniarvoisten happojen ja emästen ionit voivat olla amfolyyttejä. Esimerkiksi H2PO4– on amfolyytti, koska se voi luovuttaa protonin (= toimia happona) mutta myös vastaanottaa protonin (toimia emäksenä).
f) Neutralointireaktio
(Brønstedin mukaan)
Hapon ja emäksen välinen reaktio, jossa
syntyy vettä:
Usein neutralointireaktio-termiä käytetään myös happaman ja emäksisen aineen reaktiosta, jossa syntyy suolla ja vettä, esimerkiksi:
Tässä tilanteessa varsinainen neutraloitumisreaktio tapahtuu oksonium- ja hydroksidi-ionin välillä ja Na+ ja Cl– ovat eräänlaisia "sivustakatsojia".
Neutralointireaktiota käytetään hyväksi mitattaessa happo- ja emäsliuosten konsentraatioita titraamalla.
Huom. Jompi kumpi selitys neutralointireaktiosta kelpaa.
Pisteitysperiaate: selitys 2/3 p, esimerkki 1/3 p.
Reaktioyhtälöt
| S(s) +
O2(g) → SO2(g) 2 SO2(g) + O2(g) → 2 SO3(g)* SO3(g) + H2O(l) → H2SO4(aq) |
Verrataan aluksi prosessiin käytettävissä olevan rikin ja hapen ainemäärää:
| m (g) | S | O2 |
| 155 000 | 155 000 | |
| M (g/mol) | 32,06 | 32,00 |
| n (mol) | 4834,7 | 4843,8 |
Reaktioyhtälöiden mukaan happea tarvitaan koko prosessissa
1 mol + 0,5 mol =1,5 mol yhtä rikkimoolia kohti.
Käytettävissä olevien ainemäärien suhde:
n(O2) : n(S) = 4843,8 mol : 4834,7
mol < 1,5
Hapen ainemäärästä siis riippuu, kuinka
paljon rikkihappoa on mahdollista saada.
Reaktioyhtälöiden mukaan
n(H2SO4) = n(O2) :
1,5
n(H2SO4) = 4843,8 mol :
1,5
m(H2SO4) = 98,07 g/mol ·
4843,8 mol : 1,5 = 316,7 kg eli n. 316 kg
317 kg
normaalisti ylöspäin pyöristettynä
Toinen ratkaisumalli, jossa käytetään rikistä muotoa S8 (avautuu omaan ikkunaansa). Tiedosto 05s2.html
Huom. Olomuotomerkintöjen puuttumisesta ei vähennetty pisteitä (– 0 p).
Olettaen että liuokset ovat vesiliuoksia:
a) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
b)
2 Mg(s) + O2(g) → 2 MgO(s)
c) NH3(g) + H2O(l)
![]() NH4+(aq) + OH–(aq)
NH4+(aq) + OH–(aq)
(Osa ammoniakista vain liukenee veteen.)
d)
Na2SO4 + BaCl2(aq) → BaSO4(s) + 2
NaCl(aq)
e) Cl2 + 2 NaI(aq)
→ I2(aq*,s) + 2
NaCl(aq)
* Jos liuoksessa on
riittävästi jodidi-ioneja, ne muodostavat jodin kanssa vesiliukoisen
kompleksin I4–. Muutoin jodi on kiinteää,
mutta se voidaan liuottaa esim. bensiiniin tai alkoholiin, jolloin vapautuvan
jodin väri havaitaan. Jompi kumpi merkintä
riittää.
f) 2
CO2(g) + Ca(OH)2(aq) →
Ca(HCO3)2(aq) **
** Reaktio
CO2(g) +
Ca(OH)2(aq) → CaCO3(s) +
H2O(l)
ei riittänyt vastaukseksi (–2/3 p).
Kommentti. tehtävässä mainittiiin hiilidioksia olevan
ylimäärin.
Olomuotomerkinnät edellytettiin vastauksessa. Virheistä ja puutteista saattoi menettää 1 – 2 p.
Alkoholin molekyylikaava on C5H12O. Mahdolliset alkoholit (A – C) ovat:
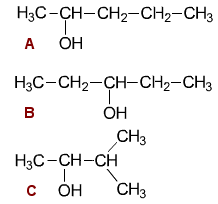
| A | 2-pentanoli |
| B | 3-pentanoli |
| C | 3-metyyli-2-butanoli |
Perustelut
Koska alkoholi saadaan ketonista
pelkistämällä, vain sekundaarinen alkoholi on mahdollinen.
Sykloalkanoli ei käy vetyatomien lukumäärän perusteella,
eikä hiiliketjussa voi olla samasta syystä kaksoissidoksia.
Huom. Maininta alkoholien sekundaarisuudesta riittää.
Ketonien kaavojen hahmottelu auttaa tehtävän ratkaisemisessa, vaikka ketonien rakenteita ei vastaukseen pyydeytäkään. Vastaavat ketonit C5H10O (omaan ikkunaan).
MAOLin pisteitysohje: kaavat 3 · (1 +1/3), nimet 3 · 2/3
Steroidirunko on merkitty kuvassa nandrolonin rakennekaavaan sinisellä. Steroidia ei tarvinnut mainita tehtävän vastauksessa.
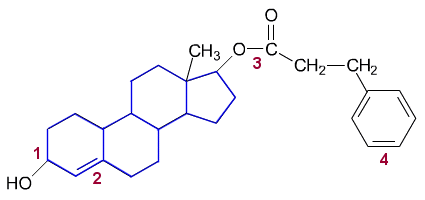
a) Nandrolonin
molekyylikaava on
C27H36O3.
b) Paitsi steroidiksi
nandroloni voidaan funktionaalisten ryhmien perusteella luokitella alkoholiksi
(1), sykloalkeeniksi (2) tai sykloalkenoliksi (1 +
2), esteriksi (3) ja aromaattiseksi yhdisteeksi
(4)
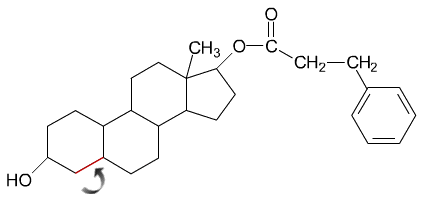
c) Ni-katalyytin avulla suoritettavassa hydrauksessa
aromaattinen rengas säilyy, mutta steroidirungon kaksoissidos
tyydyttyy.
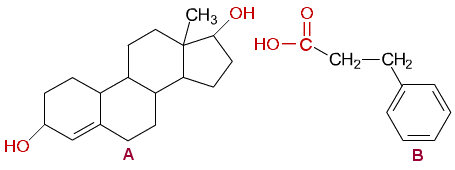
d) Hydrolysoitaessa esteri purkautuu ja syntyy alkoholi (steroidirakenteinen dioli A) ja aromaattinen karboksyylihappo (B.
Reaktio
Reaktio tapahtuu kaasufaasissa, joten reaktioastian tilavuuden pienentäminen siirtää tasapainoa oikealle (typpitetroksia syntyy lisää).
| Reaktioseoksen koostumus | ||
| Alussa n (mol) | NO2 | N2O4 |
| 0,20 | 0,20 | |
| Muutos n (mol) | –2x | +x |
| Tasapainossa n (mol) | 0,20 – 2x | 0,20 + x |
Reaktion tasapainovakio (100 °C:ssa)
K = 0,20 mol/l
: (0,20 mol/l)2 = 5,0 l/mol.
Uudessa tasapainossa tilavuus on 0,50 l, joten
konsentraatiot ovat:
c(NO2) = (0,20 – 2x)
: 0,5 mol/l = (0,40 – 4x)
mol/l
c(N2O4) = (0,20 + I) : 0,5 mol/l =
(0,40 + 2x) mol/l
Tasapainovakioksi saadaan (laadut jätetty pois lausekkeen
yksinkertaistamiseksi):
K = (0,40 + 2x) : (0,40 –
4x)2 = 5,0
Sievennetään ja saadaan yhtälö:
80x2 – 18x + 0,40 = 0
Ratkaisuksi saadaan
kaksi juurta x1 = 0,20 ja x2 =
0,025
Näistä x1 on liian suuri.
c(NO2) = (0,40 – 4x) mol/l = (0,40 –
4 · 0,025) mol/l = 0,30 mol/l
c(N2O4) =
(0,40 + 2x) mol/l = (0,40 + 2 · 0,025) mol/l = 0,45 mol/l
Koska V = 0,50 l ainemäärät
ovat:
n(NO2) = 0,5 l · 0,30 mol/l = 0,15
mol
n(N2O4) = 0,5 l · 0,45
mol/l = 0,225 mol eli n. 0,23 mol
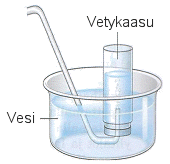
a) Vetykaasua saadaan mm.
antamalla sinkkirakeiden tai -lastujen reagoida laimeahkon suolahapon kanssa.
Sinkkijauhetta ei kannata käyttää, sillä silloin reaktio on
liian kiivas.
Reaktioastiasta (kolvi tai keitinpullo) johdetaan vetykaasu oheisen laitteiston ylösalaisin olevaan vedellä täytettyyn pulloon. Reaktioastiassa on alussa ilmaa, joten vetykaasua annetaan kehittyä sen verran, että se syrjäyttää ilman reaktioastiasta ja vasta sitten kiinnitetään kaasuletku keräysastian lasiputkeen. Työ tehdään vetokaapissa.
b) Kaasunkeräilyastiassa ei saa olla lainkaan happea vetyä sytytettäessä, koska vedyn ja hapen seos räjähtää ja seurauksena on astian rikkoutumisesta aiheutuvat haavat ja mahdollisesti laajempi tulipalo.
c) Ammoniakkia vapautuu natriumhydroksidin vesiliuoksen reagoidessa ammoniumkloridin kanssa:
Reaktiossa vapautuva ammoniakki johdetaan tulpan läpi pistetyn putken kautta kuivaan pulloon tai kolviin. Ennen kuin ammoniakkia aletaan kerätä annetaan ammoniakkikaasun syrjäyttää ilma reaktioastiasta. Työ tehdään vetokaapissa.
d) Ammoniakkikaasua ei voi kerätä vedellä täytettyyn astiaan, koska ammoniakki liukenee veteen ja reagoi sen kanssa (tehtävä 3 c)
Kts. Ammoniakin liukeneminen veteen, OPH Etälukio, kemia, laboratorio
Jäsennysehdotus