1 | 2 | 3 | 4 | 5 | 6 | +7 | kysymykset (erilliseen selainikkunaan)
a) Kulta on jalometalli, se ei siis hapetu helposti, joten sitä esiintyy luonnossa sellaisenaan. Sen keltainen väri ja suuri tiheys herättävät huomiota ja helpottavat sen erottamista muusta materiasta.
Rauta on epäjalo metalli. Se hapettuu helposti mutta on myös melko yksinkertaisella teknologialla pelkistettävissä metalliseksi. Raudan lähteinä käytetyt malmit ovat oksidimalmeja. Niistä happi saadaan erotetuksi kuumentamalla malmia hiilen kanssa riittävän korkeassa lämpötilassa.
Alumiini on rautaa epäjalompi metalli. Sen
pelkistäminen vaatii runsaasti energiaa (alumiini pelkistetään
bauksiitin ja kryoliitin sulatteesta). Ennen sähköenergian
laajamittaista tuottamista alumiinin valmistus oli hankalaa ja alumiini oli
kallista. Sähkövoimaloita alettiin rakentaa 1800-luvun lopussa.
Vrt. Yo 98 k tehtävä 2 a
b) Samalla alkuaineella voi olla useita isotooppeja, erimassaisia ytimiä. Alkuaine määritellään atomiytimen protonien lukumäärän (järjestysluvun) perusteella. Suurin järjestysluku ilmoittaa samalla alkuaineiden lukumäärän. Saman alkuaineen neutronien määrä saattaa vaihdella.
Vastaus: happea 25,8 %, vetyä 74,2 %, vettä syntyi 0,02 ml
Yksityiskohtainen ratkaisu
V(O2 +
H2) = 47,2 ml
V(H2) = 10,6 ml jäi
reagoimatta ja 36,6 ml osallistui reaktioon
V(H2) = 10,6
ml jäi reagoimatta ja 36,6 ml osallistui reaktioon
Avogadron lain
mukaan kaasureaktioissa ainemäärien suhde on sama kuin kaasujen
tilavuuksien suhde.
V(O2) = x ja x + 2x = 36,6
ml
V(H2) = 2x, josta x = 12,2 ml,
prosentteina 100 · 12,2 : 47,2 % = 25,8 %
Vetyä:
100 % – 25,8 % = 74,2 %
Suolat ovat kiteisiä yhdisteitä, joilla on ionihila. Hila rakentuu positiivisista kationeista ja negatiivisista anioneista. Vesimolekyylit ovat dipoleja: hapen puolella on pieni negatiivinen osittaisvaraus ja vetyjen puolella vastaavasti positiivinen. Niinpä vesimolekyylit voivat irrottaa kidehilaan törmäillessään ioneja ja kertyä niiden ympärille hydraattivaipaksi, joka pitää ionit erillään vesimolekyylien joukossa. Ionien ja vesimolekyylien välille muodostuu ioni-dipolisidoksia. Jos kidehilan sidokset ovat lujempia kuin vesimolekyylien ja ionien mahdolliset sidokset, liukenemista ei tapahdu. Monet orgaaniset liuottimet ovat poolittomia yhdisteitä. Niiden molekyylit eivät pysty muodostamaan tästä syystä sidoksia ionien kanssa eivätkä siten purkamaan ionihilaa.
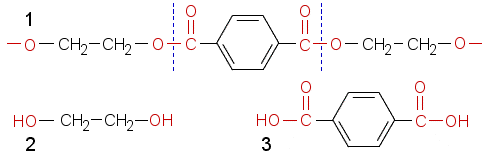
Kaava esittää tereftaalihapon ja glykolin muodostamaa polyesteriä. Emäksinen liuos (NaOH-liuos) hydrolysoi esterin lähtöaineikseen.

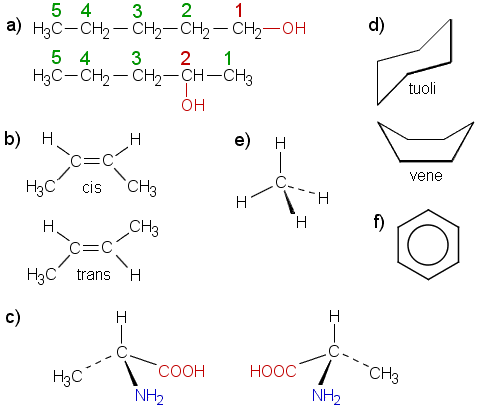
Esimerkkeinä a) 1-pentanoli ja 2-pentanoli b) cis-2-buteeni ja trans-2-buteeni c) D- ja L-alaniini d) sykloheksaanin tuoli- ja venemuoto e) metaani (symmetrinen tetraedri, C:n ja H:n elektronegatiivisuusero pieni) f) bentseeni. Monet muutkin yhdisteet kävisivät.
Sakkariinin C7H5NO3S typpiatomiin kiinnittynyt vety voi irrota protonina (sakkariini on erittäin heikko happo). Sakkariinin natriumsuolan C7H4NO3S¯ Na+ liuetessa veteen anioni toimii emäksenä (hydrolyysi), jolloin liuokseen syntyy OH¯-ioneja ja liuoksesta tulee emäksinen. Kun Na-suolan konsentraatio on c, myös anionin konsentraatio on c.
| Aine | Alussa | Tasapainossa |
| C7H4NO3S¯ | c | c – x |
| C7H5NO3S | 0 | x |
| OH¯ | 0 | x |
Allotropialla tarkoitetaan sitä, että alkuaine esiintyy useammassa kuin yhdessä rakennemuodossa samoissa olosuhteissa. Ero voi olla sidoksissa, kuten grafiitilla ja timantilla, tai kiderakenteessa, kuten tinan ja raudan allotroopeilla, tai atomien lukumäärässä, kuten hapella O2 ja otsonilla O3.
Hiilen allotrooppisiin muotoihin kuuluvat grafiitin ja timantin lisäksi fullereenit.
 Tehtävän kuvassa
vasemmanpuoleinen rakenne kuuluu grafiitille,
jossa hiiliatomit ryhmittyvät fuusioituneiksi kuusirenkaiksi siten,
että kukin hiiliatomi sitoutuu samassa tasossa kolmeen naapuriinsa.
Renkaissa hiilten välillä on yhden elektroniparin muodostamia
kovalenttisia sidoksia. Tasojen välillä puolestaan on heikkoja van
der Waalsin sidoksia. Vain puolet tasojen hiiliatomeista osuu kohdakkain.
Tasojen välimatka on huomattavasti pitempi kuin renkaan C-C-sidos. Kunkin
hiiliatomin ulkokuoren elektroneista yksi jää kovalenttisiin
sidoksiin käyttämättä. Näistä elektroneista
syntyy hiiliatomeille yhteinen elektronipilvi, joka sijoittuu rengastasojen
väliin ja jossa elektronit pääsevät liikkumaan suhteellisen
vapaasti. Niinpä kerrokset eivät olekaan lujasti kiinni toisissaan
vaan pystyvät liukumaan. Grafiitti onkin siksi hieman "rasvamaista" ja
soveltuu voiteluaineeksi. Helposti liikkuvien elektronien ansiosta se myös
johtaa sähköä. Väriltään grafiitti on
läpinäkymätöntä, tummaa ja hieman
kiiltävää. Läpinäkymättömyys ja tumma
väri kertovat siitä, että grafiitti pystyy absorboimaan valoa
laajalla aallonpituusalueella, ts. elektroneille ovat useat energiatilat
mahdollisia. Kiilto puolestaan osoittaa, että osa valosta heijastuu.
Syynä on grafiitin suhteellisen tiivis rakenne.
Tehtävän kuvassa
vasemmanpuoleinen rakenne kuuluu grafiitille,
jossa hiiliatomit ryhmittyvät fuusioituneiksi kuusirenkaiksi siten,
että kukin hiiliatomi sitoutuu samassa tasossa kolmeen naapuriinsa.
Renkaissa hiilten välillä on yhden elektroniparin muodostamia
kovalenttisia sidoksia. Tasojen välillä puolestaan on heikkoja van
der Waalsin sidoksia. Vain puolet tasojen hiiliatomeista osuu kohdakkain.
Tasojen välimatka on huomattavasti pitempi kuin renkaan C-C-sidos. Kunkin
hiiliatomin ulkokuoren elektroneista yksi jää kovalenttisiin
sidoksiin käyttämättä. Näistä elektroneista
syntyy hiiliatomeille yhteinen elektronipilvi, joka sijoittuu rengastasojen
väliin ja jossa elektronit pääsevät liikkumaan suhteellisen
vapaasti. Niinpä kerrokset eivät olekaan lujasti kiinni toisissaan
vaan pystyvät liukumaan. Grafiitti onkin siksi hieman "rasvamaista" ja
soveltuu voiteluaineeksi. Helposti liikkuvien elektronien ansiosta se myös
johtaa sähköä. Väriltään grafiitti on
läpinäkymätöntä, tummaa ja hieman
kiiltävää. Läpinäkymättömyys ja tumma
väri kertovat siitä, että grafiitti pystyy absorboimaan valoa
laajalla aallonpituusalueella, ts. elektroneille ovat useat energiatilat
mahdollisia. Kiilto puolestaan osoittaa, että osa valosta heijastuu.
Syynä on grafiitin suhteellisen tiivis rakenne.
Vrt. Syksy +8/s98
 Oikeanpuoleinen kuva esittää timantin
kiderakennetta. Kaikki hiiliatomit ovat sitoutuneet tosiinsa kovalenttisin
sidoksin, ja sidokset suuntautuvat tetraedrisesti jokaisesta hiiliatomista.
Elektronit liikkuvat suhteellisen rajatulla alueella, minkä takia
rakennelma on jäykkä. Kun sidokset lisäksi ovat lujia, on
ymmärrettävää, että timantti on kovimpia tunnettuja
aineita. Sen sulamispiste on korkea, ja se on kemiallisesti
kestävää. Elektronien rajatun liikkumatilan vuoksi timantti ei
myöskään johda sähköä. Timantti on
läpinäkyvää ja sitä käytetään
valontaitto-ominaisuuksiensa takia korukivenä.
Oikeanpuoleinen kuva esittää timantin
kiderakennetta. Kaikki hiiliatomit ovat sitoutuneet tosiinsa kovalenttisin
sidoksin, ja sidokset suuntautuvat tetraedrisesti jokaisesta hiiliatomista.
Elektronit liikkuvat suhteellisen rajatulla alueella, minkä takia
rakennelma on jäykkä. Kun sidokset lisäksi ovat lujia, on
ymmärrettävää, että timantti on kovimpia tunnettuja
aineita. Sen sulamispiste on korkea, ja se on kemiallisesti
kestävää. Elektronien rajatun liikkumatilan vuoksi timantti ei
myöskään johda sähköä. Timantti on
läpinäkyvää ja sitä käytetään
valontaitto-ominaisuuksiensa takia korukivenä.
Timantteja voidaan valmistaa keinotekoisesti, faasinmuutos grafiitista vaatii korkean paineen ja lämpötilan. Timanttirakenteisia ohuita kalvoja valmistetaan kiteyttämällä kaasufaasista sopiville pinnoille. Timanttikalvoja käytetään esim. kirurgissa instrumenteissa, laakereissa ja partakoneen terissä.
Tehtävän annossa mainittujen kahden allotroopin lisäksi hiilelle on joitakin vuosia sitten löydetty pallohiileksi tai fullereeniksi nimetty allotroopinen muoto. Fullereenin käsittely vastauksessa ei ole välttämätöntä, mutta lyhyenä mainintana (ei välttämättä niin laajasti kuin tässä esitetään) se täydentää vastausta (ja pistesaalista).
Fullereenit muodostuvat ontoista hiiliatomipalloista, suurista molekyyleistä, joissa hiiliatomit ovat sitoutuneet kovalenttisin sidoksin fuusioituneiksi viisi- ja kuusirenkaiksi. Esim. ensimmäisenä fullereenina tunnetussa C60-molekyylissä on 12 viisirengasta ja 20 kuusirengasta. Rakenneperiaate on siinä sama kuin jalkapallossa. Fullereeneja esiintyy luonnostaan mm. noessa ja joissakin kivilajeissa (shungiitti). Grafiitti ja timantti eivät liukene mihinkään tunnettuihin liuottimiin, mutta fullereenit liukenevat mm. tolueeniin ja bentseeniin, joten ne voi uuttaa erilleen noesta (noessa on pääasiassa C60, C70, noin 2 % – 10 % noen lähteestä riippuen). Fullereenikiteessä molekyylipallojen väliin jää tilaa, johon voi absorboitua kaasuja, esim. vety ja helium absorboituvat nopeasti, happi hitaammin. Kiteessä molekyylipallot pyörivät noin 20 miljardia kierrosta sekunnissa. Niinpä fullereeneista saadaan sopivilla lisäaineilla käsittelemällä magneettista orgaanista materiaalia.
Muodoltaan putkimaisia fullereenimolekyylejä on myös
onnistuttu valmistamaan. Ne ovat ikään kuin grafiitista lohkaistuja
kerroksia, jotka on kierretty rullaksi. Tällaisilla molekyyleillä on
mahdollista käyttöä sähkönjohteina.
Huomautus (hiilen allotropia)