1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Puhdas aine ja seos
Puhdas aine on joko
alkuaine tai kemiallinen yhdiste, esim. O2, H2O. Useimmat
aineet, joiden kanssa olemme tekemisissä, ovat seoksia. Mm. vesijohtovesi
on liuos, ilma taas kaasuseos ja käyttömetallit
lejeerinkejä.
b) Vahva happo on (Brønstedin teorian) mukaan aine, joka on vesiliuoksessaan täysin protolysoitunut, esim. HCl, HNO3 ja H2SO4. Syövyttävä happo on aine, jolla on tietty kemiallinen vaikutus esim. metalliin, lasiin, nahkaan jne. Syövyttävän hapon ei tarvitse olla vahva happo: em. vahvojen happojen ohella esim. CH3COOH ja HF ovat syövyttäviä happoja. Syövyttävä happo voi olla myös happoseos (esim. kuningasvesi).
c) Emäs (Brønstedin mukaan) on aine, joka voi ottaa vastaan protonin, esim. OH–, NH3, HSO4– ovat emäksiä vesiliuoksessa. Emäksinen vesiliuos on vesiliuos, jonka pH >7. Tällaisessa liuoksessa on enemmän OH–-ioneja kuin H3O+-ioneja.
d) Amorfinen aine on kiinteää ainetta, jonka rakenneyksiköillä ei ole säännöllistä järjestystä. Atomien väliset sidokset ovat eripituisia (ja erivahvuisia). Tämän takia amorfiselle aineella ei ole terävää sulamispistettä, vaan se pehmenee vähitellen lämmetessään, kuten esim. lasi. Kiteisen aineen rakennehiukkaset (ionit, molekyylit tai atomit) ovat säännöllisessä järjestyksessä ja sulamispiste on useimmiten terävä, esim. NaCl, metallit, monet orgaaniset yhdisteet (jotka tosin saattavat kuumennettaessa hajota sulamatta).
e) Galvaaninen kenno on virtalähde, esim. kuivapari. Elektrolyysikenno on sähköpari, jossa sähkövirta saa aikaan kemiallisen reaktion, esim. kloorin valmistuksessa käytetyt kennot (NaCl-sulatteen tai liuoksen elektrolyysi), kuparin elektrolyyttiseen puhdistukseen käytetyt kennot.
f) Isomeerit ovat yhdisteitä, joiden molekyylissä (tai kompleksi-ionissa) on samat atomit mutta eri järjestyksessä. Esim. CH3CH2OH (etanoli) ja CH3–O–CH3 (dimetyylieetteri) ovat toistensa isomeerejä. Isotoopit ovat saman alkuaineen erimassaisia atomeja: niillä on ytimessään yhtä monta protonia mutta eri määrä neutroneja. Esim. Vety H (1 protoni, ei yhtään neutronia) ja raskas vety D (yksi protoni ja yksi neutroni).
a) Reaktion on oltava "räjähdysreaktio",
ts. nopea, eksoterminen ja pääosin kaasumaisia tuotteita
synnyttävä. Lähtöaineseoksessa on tarpeen happea
sisältävä helposti hajoava yhdiste, jotta reaktio
pääsee nopeasti alulle. Lähtöaineiden keveys on myös
etu.
b) 236 dm3
Rikkihappo on vahva happo ja hapetin. Sen käyttö perustuu pääosin näihin ominaisuuksiin.
Eniten rikkihappoa käytetään lannoitteiden teolliseen tuotantoon. Niukkaliukoinen kalsiumfosfaatti Ca3(PO4)2 muutetaan rikkihapolla liukoiseksi divetyfosfaatiksi Ca(H2PO4)2 , jota tarvitaan superfosfaattilannoitteiden valmistukseen. Rikkihaposta ja ammoniakista valmistetaan ammoniumsulfaattia (NH4)2SO4, jota käytetään myös lannoitteissa ja lisäksi mm. veden käsittelyyn ja nahan parkitsemiseen. Rikkihappo on tarpeen väriaineiden, räjähteiden, pesuaineiden (sulfonihappojen), muovien, tekokuitujen ja toisten happojen (esim. H3PO4 ja kuiva HCl) valmistuksessa. Rikkihapolla on laajaa käyttöä metallurgiassa, mm. teräksen valmistuksessa. Muita käyttökohteita: lyijyakkujen elektrolyyttiliuokset, alumiinisulfaatin Al2(SO4)3 ja Glauber-suolan Na2SO4 valmistus.
Neutralointiin tarvitaan 2 800 kg Na2CO3
Ratkaisu
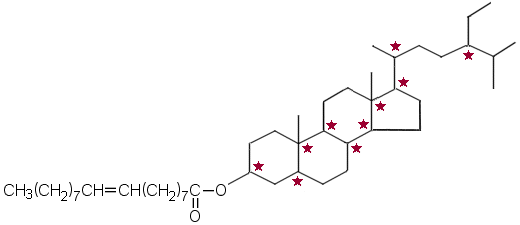
a) Kuvassa on hydratun sitostanolin ja öljyhapon esteri. Asymmetriset hiiliatomiton merkitty tähdellä. Vastaukseen riitti yhden asymmetrisen hiiliatomin merkitseminen kaavaan.

b) Asymmetriseen hiiliatomiin on sitoutunut neljä erilaista atomia tai atomiryhmää. Tällaisen C-atomin (tai -atomeja) sisältävä yhdiste on optisesti aktiivinen eli se kääntää tasopolaroidun valon värähtelytasoa. Asymmetrinen hiiliatomi tekee molekyylistä kiraalisen: jokaista asymmetristä hiiliatomia kohti on kaksi optista isomeeriä, D- ja L-isomeerit (R ja S), jotka kääntävät valon värähtelytasoa päinvastaisiin suuntiin ja ovat toistensa peilikuvia. Entsyymien katalysoimissa reaktioissa tavallisesti vain toinen isomeeri pystyy reagoimaan.
Sykloheksaani C6H12 on tyydyttynyt rengasrakenteinen hiilivety ja bentseeni C6H6 on 6 vetyatomia vähemmän sisältävä aromaattinen hiilivety. Bentseeni ei kuitenkaan reaktioissaan muistuta tyydyttymätöntä yhdistettä: additio (esim. hydraus) tapahtuu vaikeasti mutta substituutio suunnilleen yhtä helposti kuin sykloheksaaniin.
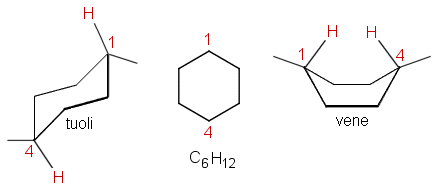
Sykloheksaanin venemuodossa C-atomeihin 1 ja 4 sitoutuneet H-atomit joutuvat lähemmäs toisiaan kuin tuolimuodossa. Tästä syystä venemuoto ei ole niin stabiili kuin tuolimuoto.
Sykloheksaanin rengas muodostuu (sp3-hybridisoituneista) hiiliatomeista yksinkertaisin sidoksin. C-atomeista lähtevät sidokset suuntautuvat tetraedrisesti, joten sidoskulmat ovat noin 109,5 °. Tästä syystä sykloheksaanirengas ei ole tasomainen. Yksinkertaisessa C–C-sidoksessa C-atomit pääsevät kiertymään sidosakselin ympäri, minkä seurauksena hiiliketju voi asettua eri konformaatioihin. Näin on myös sykloheksaanissa, jossa kuitenkin rengas rajoittaa kiertymistä osittain. Sykloheksaanin tärkeimmät konformaatiot ovat tuoli- ja venemuoto, joista tuolimuoto on energeettisesti edullisempi.
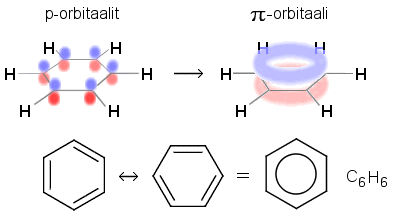
Bentseenissä hiilirenkaan ylä- ja alapuolelle muodostuu yhtenäinen renkaan muotoinen π-elektronipilvi (orbitaali), kun tavalliseen sp2-hybridisaatioon kuuluvat py-orbitaalit yhtyvät.
Bentseenissä C6H6 hiiliatomit (sp2-hybridisoituneet) liittyvät toisiinsa sidoksin, jotka ovat pituudeltaan ja energialtaan yksinkertaisen sidoksen ja kaksoissidoksen välillä (pituus bentseenissä on 139 pm, C=C-sidos 134 pm, C–C-sidos 154 pm, energiat vastaavasti 518 , 612 ja 348 kJ/mol).
Bentseenin sidoskulmat ovat kuitenkin samat kuin kaksoissidoksen C-atomeilla eli 120 °. Rengasrakenne on tasomainen. C-atomien hybridisoitumattomista p-orbitaaleista muodostuu renkaan ylä- ja alapuolelle elektronipilvi, jossa on 6 elektronia tasaisesti jakautuneina kaikkien C-atomien läheisyyteen. Tämä selittää bentseenille tyypilliset reaktiot ja rakenteen stabiiliuden. Bentseenin rakennetta kuvataan resonanssimuodoilla, joissa kaksoissidokset ovat vuorotellen eri C-atomien välillä tai piirtämällä rengas C-C-sidoksista syntyvän kuusikulmion sisään.
HUOM. Hybridisaatiotyypin mainitsemista ei vaadittu. Arvot ovat taulukkokirjasta.
a) Katalyytti nopeuttaa reaktiota vaikka ei
vaikutakaan tasapainoaseman loppukonsentraatioihin. Katalyytillä voidaan
myös estää sivutuotteiden muodostumista (toinen
katalyyttivalinta tuottaisi esim. glykolia).
Le Châtelier'n
periaatteen mukaisesti:
Matala lämpötila. Reaktio on
eksoterminen (ΔH = –90,2 kJ), joten matala
lämpötila suosii tuotteiden muodostumista.
Korkea paine.
Reaktio tapahtuu kaasufaasissa, jolloin korkea paine edistää
kaasumolekyylien lukumäärän vähenemistä. Tuotteen
muodostuessa kolmesta molekyylista tulee yksi molekyyli.
b) K =
24 (l/mol)2
Ratkaisu
| ainemäärä n | CO(g) | H2(g) | CH3OH(g) | yksikkö |
| alussa | 2,0 | 1,0 | 0 | mol/l |
| tasapainossa | 2,0 – 0,18 = 1,82 | 1,0 – 2 · 0,18 = 0,64 | 0,18 | mol/l |
Tasapainovakion lauseke:
1. Laboratoriossa vetyä valmistetaan useimmiten hapettamalla epäjaloa metallia laimeassa happoliuoksessa (10 % - 20 %). Hapoksi voidaan valita HCl tai jokin muu happo (myös etikkahappo käy).
Voidaan myös käyttää alkali- tai maa-alkalimetallin reaktiota veden kanssa. (Na:n reaktio on kiivas, joten se ei ole paras mahdollinen valinta.)
2. Vetykaasua syntyy myös hajotettaessa vettä elektrolyyttisesti:
Vety tunnistetaan palamisreaktion perusteella: kuuluu tyypillinen "haukahdus", kun pieni määrä vetyä palaa räjähtäen ilmaan sekoittuessaan.
Vedyn ainemäärä n(H2) lasketaan ideaalikaasun
tilanyhtälöstä, kun vedyn tilavuus on määritetty.
Lisäksi on tunnettava mittaushetkellä vallitseva paine (p) ja
lämpötila (T).
n(H2) = pV : RT (R on
yleinen kaasuvakio.)
Kokeen suoritus
1. Pieniä metallirakeita (Zn tai Mg) pannaan kaasunkehitysputkeen (putkessa on huokoinen alapää) ja suljetaan putki kumitulpalla, jonka läpi on pistetty taivutettu lasiputki kaasun ulostulotieksi. Kaasunkehitysputki tuetaan happoliuosta sisältävään (tai Ca:n tapauksessa vettä sisältävään) keitinlasiin. Asetetaan ulostuloputken pää vesiastiaan. Kaasukuplat kerätään esim. alassuin käännettyyn vedellä täytettyyn mittalasiin (tilavuuden määritys tosin ei ole kovin tarkka).
2. Vedenhajotuslaitteistossa on kahta nurinpäin asetettua byrettiä muistuttava (mitta-asteikko ja hanat) putkiparia, jonka alaosaan asetetaan Pt-elektrodit. Laite täytetään elektrolyyttiliuoksella (esim. laimea Na2SO4) ja tuetaan statiivilla elektrolyyttiliuosta sisältävään astiaan (esim. keitinlasiin). Elektrodit kytketään tasajännitelähteeseen. Veden hajoamiselle E = –1,23 V, mutta käytännössä tarvitaan n. 1,8 V:n jännite. Vety pelkistyy katodilla (–).
HUOM. Yksi valmistustapa riittää vastaukseksi.
Aineet luokitellaan sähkönjohtokyvyn perusteella johteisiin, puolijohteisiin ja eristeisiin.
Johtavuus edellyttää sitä, että elektronit tai ionit pääsevät liikkumaan aineessa.
Metallit ovat johteita, jossa elektronit pääsevät liikkumaan lähes vapaasti mihin suuntaan tahansa. Metalliatomien uloimmalla kuorella on niukasti elektroneja. Atomien pakkautuessa yhteen yhteen metallihilaksi, elektronit eivät riitä muodostamaan kovalenttisia sidoksia vaan siirtyvät atomilta toiselle ja muodostavat ns. elektronimeren, joka voidaan ajatella myös suureksi yhteiseksi orbitaaliksi (johtavuusvyöksi). Elektronit pystyvät liikkumaan vyöllä, koska se ei ole täysin miehitetty. Metallien sähkönjohtavuus pienenee lämpötilan kohotessa, koska atomien lämpöliikkeen voimistuminen aiheuttaa elektronien sirontaa. Myös metallien kiderakenteen virheet ja epäpuhtaudet aiheuttavat tavallisissa lämpötiloissa vastaavaa resistanssin kasvua.
Grafiitin rakenteessa hiiliatomit
muodostavat kerroksittain asettuvia kuusirenkaista koostuvia tasoja. Kukin
hiiliatomi sitoutuu kolmeen naapuriinsa samassa tasossa. Tasojen välimatka
on pitempi kuin C–C-sidos itse renkaissa. Eri kerrosten hiilirenkaat
asettuvat siten, etteivät renkaiden keskukset ole pystysuorasti
kohdakkain, joten hiiliatomeista vain puolet osuu päällekkäin.
Tasojen väliin jää alue, jossa elektronit vaeltavat suhteellisen
vapaasti. Grafiitissa, kuten metalleissakin, sähkövirta
pääsee liikkumaan mihin suuntaan tahansa. Johtavuus on kuitenkin
grafiitissa parempi tasojen suuntaan kuin tasoja vastaan pystysuunnassa.
Vrt. tehtävän 5 bentseenin
rakenteeseen
Vrt. tehtävä
+8/s95
 |
 |
 |
| Metallijohteen rakenneperiaate | Grafiitin rakenneperiaate sivulta ja kohtisuoraan tasoihin nähden | |
Ioniyhdisteet purkautuvat sulatteessa ja liuetessaan (veteen) kationeiksi ja anioneiksi, jotka liikkuessaan kuljettavat sähkövirtaa.
Esimerkki
Hapot ja emäkset muodostavat ioneja protolysoituessaan. Niiden vesiliuokset toimivat siten johteina.
Esimerkki
Ioniyhdisteitä, happoja ja emäksiä nimitetään elektrolyyteiksi ja niiden (vesi)liuoksia elektrolyyttiliuoksiksi. Elektrolyyttiliuosten sähkönjohtokyky riippuu mm. siitä, kuinka paljon ioneja liuoksessa on: vahvat hapot ja emäkset ovat myös vahvoja elektrolyyttejä ja heikot vastaavasti heikkoja elektrolyyttejä. Runsasliukoiset ioniyhdisteet ovat vesiliuoksissaan vahvoja elektolyyttejä, niukkaliukoiset heikkoja. Lämmittäminen parantaa elektrolyyttien ja elektrolyyttiliuosten johtavuutta tiettyyn rajaan saakka. Elektrolyyteillä on suuri käytännön merkitys galvaanisissa ja elektrolyysikennoissa. Elimistössä hermoimpulssien kulku perustuu elektrolyyttien kuljettamaan sähkövirtaan.
Oman luokkansa johteissa muodostavat suprajohteet, joissa resistanssi häviää alhaisissa lämpötiloissa. Useat metallit (esim. Hg, Sn, Pb) ja lejeeringit muuttuvat suprajohtaviksi lähestyttäessä absoluuttista nollapistettä. Niitä korkeammissa lämpötiloissa suprajohteina toimivat jotkin keraamiset ei-stoikiometriset yhdisteet ja eräät doupantteja sisältävät orgaaniset molekyylit sekä fullereenit. Suprajohtavuuden mekanismia ei ole vielä aukottomasti selitetty.
Puolijohteissa varauksenkuljettajina toimivat
elektronit (n-tyypin puolijohde) tai positiiviset aukot (p-tyypin
puolijohde). Puolijohteen sähkönjohtavuus paranee
lämmitettäessä.
 |
 |
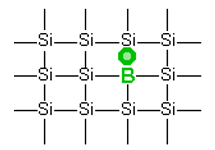
| Positiiviset aukot p-tyypin puolijohde |
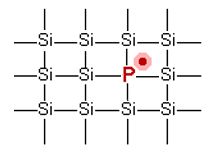
Negatiiset elektronit n-tyypin puolijohde |
Tyypillinen puolijohde on esimerkiksi pienillä määrillä booria (B) tai fosforia (P) doupattu pii (Si). Si-atomilla on uloimmalla kuorellaan neljä elektronia. Niinpä piiatomit muodostavat keskenään hilan tetraedrisesti suuntautunein kovalenttisin sidoksin. Hilaan syntyy häiriö, kun mukaan liitetään fosforiatomi, jolla 5 elektronia uloimmalla kuorellaan, tai booriatomi, jolla on vastaavasti kolme elektronia. P:n tapauksessa ylimääräinen elektroni siirtyy hilassa atomilta toiselle. B:n tapauksessa syntyy yhden elektronin vajauksesta aukko, joka siirtyy hilassa eteenpäin (itse asiassa elektroni siirtyy ja jälkeen jää uusi aukko). Lämmittäminen auttaa kummassakin tapauksessa elektronia saamaan riittävästi energiaa siirtyäkseen. Sekä epäorgaanisissa että orgaanisissa puolijohteissa virran kulkusuuntaa rajoittaa sidosten suuntautuminen toisin kuin metallijohteessa ja grafiitissa.
 |
 |
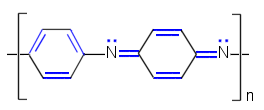 |
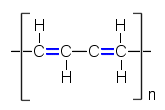
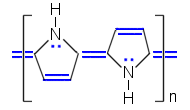
| Polyasetyleeni | Polypyrroli | Polyaniliini |
| Puolijohteina voivat toimia myös konjugoituja kaksoissidoksia sisältävät polymeeriset hiiliyhdisteet, mm. polyasetyleeni, polypyrroli ja polyaniliini. Nämäkin yhdisteet tarvitsevat doupanttia johtavuuden saavuttamiseen. Doupanttiksi sopii esimerkiksi I2. | ||
Eristeitä ovat sellaiset aineet, joissa elektronit ovat lokalisoituneet täysille molekyyliorbitaaleille tai joissa varaukset eivät pääse liikkumaan tai joista puuttuvat rakenneyksiköiden väliset sidokset (kuivat, kiteiset suolat ja molekyyliyhdisteet, kaasut). Esimerkiksi puhdas timantti on eriste, jonka kidehilassa C-atomit ovat sitoutuneet tetraedrisesti suuntautunein kovalenttisin sidoksin. Elektronit eivät siten pääse vaeltamaan timantin kidehilassa. Jos kuitenkin timantin kidehilaan tuodaan epäpuhtauksia, timantista tulee puolijohde. Lasi on myös eriste. Se on verkkorakenteinen aine, jossa rakenneosaset ovat sitoutuneet vahvoin ionisidoksin ja kovalenttisin sidoksin. Joten elektronit ovat lokalisoituneita. Poolisetkaan molekyyliyhdisteet eivät johda sähköä, koska osittaisvarausten väliset vuorovaikutukset pitävät molekyylit toisiinsa nähden sellaisissa asemissa, että varaukset kumoavat toisensa.