 |
 |
| Kuvassa on yhdisteen lankamalli,
josta renkaan vääntyminen näkyy. (Kuvaa ei toki vastaukseen tarvinnut piirtää.) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Kun sekoitetaan 50 ml
etanolia ja 50 ml vettä, saadaan 95 ml eikä 100 ml liuosta.
Tilavuuden supistuminen johtuu siitä, että etanolimolekyylien ja
vesimolekyylien välille muodostuu vetysidoksia, jotka vetävät
molekyylit lähekkäin. Etanolimolekyylien ja vesimolekyylien muoto
poikkeaa toisistaan, joten etanolin ja veden sitoutuessa vetysidoksin toisiinsa
saavutetaan pienempi kokonaistilavuus kuin pelkkien vesi- tai
etanolimolekyylien sitoutuessa toisiinsa.
Vrt. Yo 98 k tehtävä 1
b) Hiilidioksidi CO2 on hapan oksidi. Osa veteen liuenneesta hiilidioksidista reagoi veden autoprotolyysissä syntyneiden hydroksidi-ionien kanssa muodostaen vetykarbonaatti-ioneja.
Vetykarbonaatti-ioni HCO3– on hiilihapon H2CO3 konjugaattiemäs. Hiilihappo on heikko, pysymätön happo. Puhtaan veden ja CO2:n reagoidessa syntyy siten vain hieman oksonium- ja vetykarbonaatti-ioneja, pH asettuu likimain arvoon 6. NaOH-liuos on vahvasti emäksinen. Liuoksessa on läsnä hydroksidi-ionien määrää vastaava määrä Na+-ioneja. Suola NaHCO3 on erittäin vesiliukoinen, joten CO2 liukenee sen mukaisesti.
(Vastaukseksi riittää yksinkertaisempikin selitys, jossa todetaan CO2:n happamuus ja hiilihapon pysymättömyys sekä emäksisessä liuoksessa tapahtuva osittainen neutraloituminen.)
c) Rikkitrioksidimolekyylissä rikkiatomi on keskellä ja happiatomit sen ympärillä. Molekyylin rakenne on tasomainen, joten ulospäin molekyyli on pooliton.
Tasapainotettu reaktioyhtälö:
Fosforin P4 hapetusluku on 0. Fosfiinissa PH3 P:n
hapetusluku on –3. Fosforihapossa H3PO4 P:n
hapetuslukuna on +5. Fosfori siis sekä hapettuu että pelkistyy
reaktion kuluessa.
Fosforia tarvitaan 6,3 g.
Yksityiskohtainen ratkaisu
| PH3: | x + 3 · (+1) = 0 , joten x = –3 |
| H3PO4: | 3 · (+1) + y + 4 · (–2) = 0, tästä y = +5 |
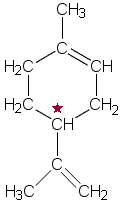
a) Kaavan esittämä yhdiste on tyydyttymätön rengasrakenteinen hiilivety, jonka renkaassa on 6 hiiliatomia. Yhdiste on syklohekseeni, jossa on para-asemassa kaksi substituenttia, metyyliryhmä ja kaksoissidoksen sisältävä isopropenyyliryhmä.
 |
 |
| Kuvassa on yhdisteen lankamalli,
josta renkaan vääntyminen näkyy. (Kuvaa ei toki vastaukseen tarvinnut piirtää.) |
b) Rengasrakenne ei ole tasomainen, koska siihen sisältyy 5 yksinkertaista C-C-sidosta, joissa hiilellä (4 kpl) on sp3-hybridisaatio (tetraedrisesti suuntautuneet sidokset).
c) Sivuketjun kaksoissidoksen toiseen hiiliatomiin on liittynyt kaksi H-atomia. Sivuketjun osalta ei siis ole mahdollisuutta cis-trans -isomeriaan. Renkaan kaksoissidoksen hiiliatomeihin voivat renkaan hiiliatomit (tai metyyliryhmä ja vetyatomi) periaatteessa olla kiinnittyneet joko samalta tai eri puolelta. Kuuden hiiliatomin renkaassa trans-asemasta lähtevä rengasrakenne kuitenkin muodostuisi liian jännittyneeksi, joten se ei ole todennäköinen vaihtoehto. Cis-trans-isomeriaa ei siis esiinny.
d) Yhdisteessä on asymmetrinen hiiliatomi (kuvassa merkitty tähdellä ), joten yhdiste on optisesti aktiivinen.
a) Eniten energiaa (140 kJ/g) tuottaa vety (H2) palaessaan.
Perustelut
Lasketaan vapautuvan energian
määrä yhtä poltettavaa ainegrammaa kohti.
b) Eniten hiilidioksidia tuottaa grafiitin (C) polttaminen.
Perustelut
Eniten hiilidioksidia syntyy siis grafiitin palaessa.
c) Hiilidioksidi kuuluu luonnon normaaliin ja elämälle välttämättömään hiilikiertoon: se on veden ohella lähtöaineena fotosynteesissä. Siitä huolimatta CO2:a voidaan pitää ilman saasteena, kun sen määrä ilmassa kasvaa normaalia pitoisuutta (n. 0,033 %) suuremmaksi. Hiilidioksidi ei toki suoranaisesti ole myrkyllistä suurinakaan pitoisuuksina, ellei se syrjäytä hengitysilmasta happea. Sen sijaan CO2 absorboi tehokkaasti infrapunasäteilyä (lämpöä). CO2 onkin vesihöyryn ohella tärkein ns. kasvihuonekaasuista, jotka päästävät auringon valon kulkeutumaan maan pinnalle, mutta hidastavat lämmön haihtumista pois. Tämäkin ominaisuus on tosin maapallon elämän kannalta välttämätön, koska se pitää ilmakehän lämpötilan siedettävissä rajoissa. Hiilidioksidin määrän kasvaessa on kuitenkin vaarana ilmakehän liiallinen lämpiäminen. Koska ihmisen toiminta vaikuttaa ilmakehän hiilidioksidimääriin (muttei vesihöyryn määrään), liika hiilidioksidi voidaan luokitella ilman saasteeksi. Tärkein hiilidioksidikuormituksen aiheuttaja on hiilipitoisten aineiden, kuten puun, kivihiilen, öljyn, bensiinin ja jätteen polttaminen.
Ilmastonmuutos (Sivulta on linkki Ilmatieteen laitoksen sivustoon)
a) Saostumaa ei muodostu.
Perustelut
b) pH = 10
Aspartaami on dipeptidi, jossa on metyyliesteriryhmä.
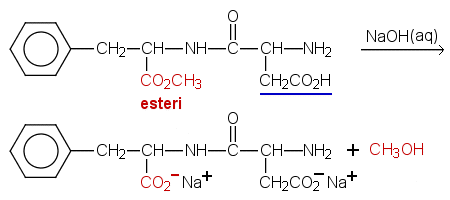
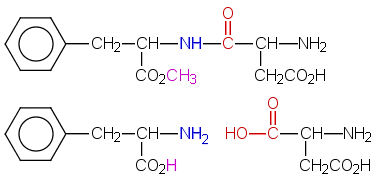
Aluksi lasketaan, paljonko NaOH-rakeita on punnittava noin 0,1 M liuokseen, jota valmistetaan 250 ml.
 Punnitaan NaOH-rakeita 1,0 g.
Siirretään ne varovasti esim. taitetun paperin avulla 250 ml:n
mittapulloon. Liuotetaan rakeet pullossa tislattuun veteen. Liuos lämpenee
rakeiden liuetessa, joten jäähdytetään pullo nopeasti
jäähauteessa noin 20 °C lämpötilaan.
Lisätään tislattua vettä mittapullon kaulamerkkiin saakka.
Sekoitetaan hyvin suljettua pulloa kallistellen.
Punnitaan NaOH-rakeita 1,0 g.
Siirretään ne varovasti esim. taitetun paperin avulla 250 ml:n
mittapulloon. Liuotetaan rakeet pullossa tislattuun veteen. Liuos lämpenee
rakeiden liuetessa, joten jäähdytetään pullo nopeasti
jäähauteessa noin 20 °C lämpötilaan.
Lisätään tislattua vettä mittapullon kaulamerkkiin saakka.
Sekoitetaan hyvin suljettua pulloa kallistellen.
Liuoksen konsentraatio tarkistetaan titraamalla 0,200 M HCl-liuoksella. HCl-liuosta pannaan byrettiin (esim.10 ml byretti). Tislatulla vedellä huuhdeltuun keitinlasiin tai -pulloon mitataan täyspipetillä tarkasti 5 ml (tai 10 ml) NaOH-liuosta ja lisätään hieman tislattua vettä. Byretistä tiputetaan varovasti HCl-liuosta ja samalla rekisteröidään pH-mittarilla titrauskäyrä ja luetaan siitä ekvivalenttikohtaa vastaava HCl-kulutus tai luetaan muuten pH-arvoa 7 vastaava kulutus. Määritys toistetaan tuloksen varmentamiseksi.
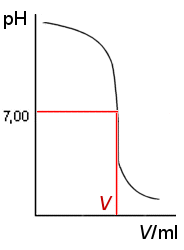
NaOH:n konsentraation laskeminen.
V(NaOH) · c(NaOH) = V(HCl)
· c(HCl)
c(NaOH) = V(HCl) ·
c(HCl) : V(NaOH)
V(NaOH) = NaOH-näytteen
tilavuus (ml)
V(HCl) = HCl:n kulutus (ml)
c(HCl) =
0,200 M
Ohje: Natriumin ja kuparin vertailussa on käsiteltävä kummankin metallin ominaisuuksia alkaen elektroniverhon rakenteesta ja tavallisimmista hapetusasteista. Molempien metallien valmistusta ja käyttöä on myös vertailtava, samoin tavallisimpia yhdisteitä.
Linkkejä
Natriumille:
Salt Institute
Kuparille: copper.org |
Outokumpu
Oy
Malmeista:
Metalliset malmit
GTK/tutkimus