1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Saippuan käyttö tehostaa kahdella tavalla pesuvaikutusta: alentamalla veden pintajännitystä ts. parantamalla sen "kastelevuutta" ja toisaalta irrottamalla likaa pieniksi hiukkasiksi (dispergoimalla likaa). Molemmat vaikutukset johtuvat saippuan kemiallisesta rakenteesta. Saippuahan on pitkäketjuisten rasvahappojen natriumsuola. Vedessä suola ionisoituu, jolloin veteen irtoaa kookkaita rasvahappoanioneja.

Veden pintajännitys johtuu vesimolekyylien välisistä voimakkaista vetysidoksista. Esimerkiksi kuidun tai ihon ja veden välillä sidosten muodostumismahdollisuutta ei ole, joten vesi pisaroi eikä heti kastele niitä. Saippuasta irronnut anioni kuitenkin vetää vesimolekyylejä puoleensa negatiivisella varauksellaan ja toisaalta karkottaa poolittomalla hiilivetyhännällään, seurauksena on vesimolekyylien välisten sidosten häiriintyminen, esim. veden pinnassa saippua-anionien hiilivetyhännät kääntyvät veden pinnasta ulospäin.
Liassa on aina mukana rasvaa ja muita veteen niukkaliukoisia aineita. Anionin pooliton hiilivetyhäntä kääntyy näitä hiukkasia kohti. Anioneja kertyy hiukkasen ympärille ja syntyy kerros, jossa karboksyyliryhmät ovat kääntyneet ulospäin. Hiukkasen ulkopinta saa näin negatiivisen varauksen, Varautuneet hiukkaset karkottavat toisiaan ja vetävät puoleensa vesimolekyylejä, jotka ovat dipoleja. Hiukkaset huuhtoutuvat veden mukana pois. Talousvedessä on aina mukana kalsiumioneja (Ca2+), jotka muodostavat saippua-anionin kanssa niukkaliukoisen suolan (kalkkisaippua). Suolan muodostuminen häiritsee pesutapahtumaa: hiukkaset takertuvat esim. kuituihin ja pesuastian seinämiin.
b) Marmori on pääosin kalsiumkarbonaattia CaCO3. Ilmaan kulkeutuneet happamat aineet reagoivat karbonaatin kanssa, jolloin vapautuu hiilidioksidia CO2 ja marmoriveistoksen pintaan tulee pieniä aukkoja. Aukkoihin kertyy vettä. Lämpötilan vaihtelut aiheuttavat veden ajoittaista laajentumista. Sen seurauksena veistos rapautuu.
Sadevesi on ilmassa olevan hiilidioksidin takia jo luonnostaan hieman hapanta, mutta liikenteen, asuntojen lämmityksen ja teollisuuden ilmaan päästämä rikkidioksidi SO2 happamoittaa sadevettä lisää. Sadeveden luonnollinen happamuus:
Välivaiheena voidaan ajatella syntyvän hiilihappoa H2CO3.
Rikkidioksidin aiheuttama happamuus (rikkihapoke voi hapettua myös rikkihapoksi):
c) Muurilaasti on seos, joka sisältää mm. hiekkaa (pääosin SiO2) sekä veteen lietettyä kalsiumhydroksidia Ca(OH)2. Ilman hiilidioksidi CO2, hapan oksidi, reagoi emäksisen Ca(OH)2 :n kanssa.
Veden haihtuessa ja CaCO3:n kiteytyessä syntyy kiinteä suhteellisen tiivis massa.
d) Hopeaesineet tummuvat ilmassa hapettumisen seurauksena. Vaikka hopea, Ag, on jalo metalli, se reagoi vähitellen ilmassa olevien rikkiyhdisteiden kanssa. Hopeasulfidi Ag2S on väriltään mustanharmaata.
e) Kananmunan valkuainen sisältää vettä ja pitkistä kierteisistä aminohappoketjuista muodostunutta globulaarista proteiinia. Kuumennettaessa proteiiniketjujen sekundaarinen rakenne häiriintyy, proteiini denaturoituu. Rakennetta ylläpitävät vetysidokset, poolittomat sivuryhmien väliset vuorovaikutukset, ionien väliset vuorovaikutukset suuntautuvat uudelleen ja vesimolekyylit sitoutuvat syntyvään uuteen proteiiniketjujen muodostamaan verkostoon. Proteiini koaguloituu. Tuloksena on kiinteä yhtenäinen massa.
Osmoosi on liuottimen kulkeutumista puoliläpäisevän kalvon läpi laimeammasta liuoksesta väkevämpään, siis sieltä missä on enemmän liuotinta sinne missä on vähemmän liuotinta. Hiukkaset, liuotinmolekyylit ja liuenneen aineen molekyylit tai ionit ovat liuoksissa koko ajan liikkeessä, joten konsentraatioerot tasoittuvat niissä vähitellen itsestään. Jos eriväkevyiset liuokset erotetaan toisistaan kalvolla, josta vain vesimolekyylit pääsevät läpi, konsentraatioero pienenee tällöinkin. Vesimolekyylejä siirtyy enemmän sille puolelle kalvoa, missä liuos oli alkuaan väkevämpää.
Kalvoa sanotaan puoliläpäiseväksi, jos vain osa liuoksessa olevista aineista pääsee sen läpi. Tällainen kalvo on esimerkiksi solukalvo. Vesi pääsee helposti kulkeutumaan sen läpi. Jos solun ulkopuolella on vähemmän liuenneita aineita kuin sisäpuolella, soluun virtaa vettä ja solu paisuu. Jos solun ulkopuolella taas on runsaammin liuenneita aineita kuin sisäpuolella, solusta poistuu vettä ja se kutistuu. Molemmissa tapauksissa solun muodon muuttumisen aiheuttaa ulkoisen ja sisäisen hydrostaattisen paineen ero. Puhtaan liuottimen ja liuoksen välistä paine-eroa nimitetään osmoottiseksi paineeksi.
Huomautus solukalvon toiminnasta
Jokaisen elävän solun toiminnan kannalta on tärkeää, että osmoottinen paine pysyy oikean suuruisena: liian suuri tai liian pieni osmoottinen paine saattaa jopa tuhota solun kokonaan. Tästä syystä sairaaloissa käytetään fysiologista suolaliuosta, kun potilaan nestetasapainoa joudutaan ylläpitämään suoraan suoneen annettavalla liuoksella. Fysiologisen suolaliuoksen (0,15 M eli 0,9 % NaCl) osmoottinen paine on sama kuin veriplasmalla (n. 7,4 bar). Pitkään jatkunut nesteen vajaus on vaarallista, mm. aivojen ja sydämen toiminta vaikeutuu, ja vaarana on hengen menetys. Nesteen vajauksen korvaamiseen käytetään varsinkin alkeellisissa olosuhteissa myös suun kautta nautittavaa ravintosuoloja ja glukoosia sisältävää nestettä.
Osmoottisen paineen ansiosta kasvit pystyvät ottamaan juurillaan vettä ja kuljettamaan sen runkoon, lehtiin ja kukkiin.
Osmoottisen paineen vaikutusta käytetään hyväksi myös säilönnässä. Vahva sokeri- tai suolaliuos pystyy tuhoamaan mikrobien solut aiheuttamalla nesteen virtauksen ulos soluista. Tietysti tämä vaikuttaa myös itse säilöttävän elintarvikkeen rakenteeseen, esim. suolakurkut ovat alkuperäisiin kurkkuihin verrattuina huomattavasti kutistuneita.
Nesteen ja ionien poistuminen munuaisen kautta ihmiselimistöstä on riippuvainen osmoosista ja siksi mm. runsas suolan käyttö aiheuttaa ongelmia, kuten turvotusta ja verenpaineen kohoamista.
Osmoosi voidaan myös kääntää keinotekoisesti, käyttämällä hyvin suuria paineita (70 baria). Muutamilla seuduilla mm. Saudi-Arabian rannikolla ja osissa Pohjois-Amerikkaa on niukasti makeaa vettä. Talousvettä joudutaan puhdistamaan siellä merivedestä tai suolaisesta pohjavedestä. Puoliläpäisevänä kalvona on tavallisimmin puhdistussäiliöön kerroksittain pakattu selluloosa-asetaatin ja polyamidien seos. Näiden aineiden molekyylien pooliset ryhmät hylkivät negatiivisia ioneja, jotka siitä syystä eivät pääse kulkeutumaan kalvon läpi. Sähköiset vetovoimat puolestaan estävät tällöin myös positiivisten ionien läpipääsyn. Käänteistä osmoosia käytetään myös yhtenä vaiheena valmistettaessa laboratoriotarkoituksiin erittäin puhdasta vettä.
Asetyleeniä muodostuu 2,23 ml.
Reaktioyhtälö
Reaktioyhtälön mukaisesti:
n(C2H2) = 0,5 ·
n(OH– ) = 0,5 ·
10–2,70 mol/l · 1,00
l
V(C2H2) = 0,5 ·
10–2,70 mol · 22,4 l = 2,23 ml
a) Mentolissa on vain yksi funktionaalinen ryhmä, alkoholihydroksyyli.

b) Mentolilla esiintyy konformaatioisomeriaa, koska siinä on yksinkertaisin C–C-sidoksin muodostunut kuusirengas, joka voi taipua tuoli- tai venemuotoon. Lisäksi mentolissa on isopropyyliryhmä, joka voi kiertyä eri asemaan renkaaseen nähden. (Kaikki renkaaseen liittyneet ryhmät tai atomit voivat olla joko aksiaalisesti tai ekvatoriaalisesti suuntautuneita. Muodosta toiseen siirtyminen tapahtuu renkaan vääntyessä.

c) Mentolissa on kolme asymmetristä hiiliatomia. Asymmetrinen hiiliatomi on sitoutunut neljään erilaiseen ryhmään tai atomiin. (Merkitty kuvaan tähdellä.)
d) Mentolia (A) hapetettaessa syntyy ketoni, mentoni (B).
Le Châtelier'n periaatteesta — systeemi vastustaa siihen kohdistuvaa muutosta — löytyy esityksiä esimerkkeineen kaikista lukion kemian oppikirjasarjoista. Periaatetta käytetään hyväksi mm. monissa teollisissa sovelluksissa, joilla ohjataan synteesien kulkua. Esimerkiksi poistamalla tuotetta koko ajan saadaan syntymään lisää tuotetta jatkuvasti, koska kemiallisen tasapainon häirintä aiheuttaa uuteen tasapainotilaan siirtymisen.
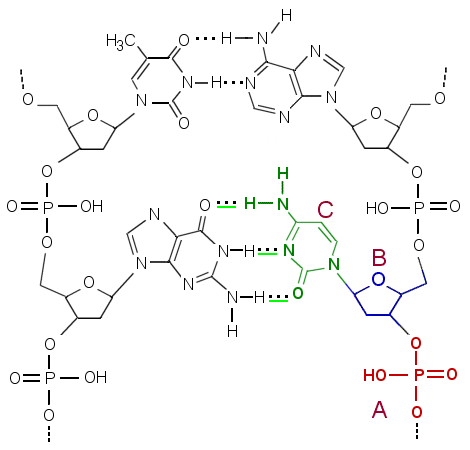
a) DNA (deoksiribonukleiinihappo) muodostuu nukleotidiryhmistä, joissa on heterosyklinen emäs, deoksiriboosi (kja fosfaattiryhmä peräkkäin sitoutuneina. b) Ketjujen emäkset asettuvat kohdakkain ja emästen välille syntyy vetysidoksia. Vetysidokset syntyvät karbonyylihapen, N- , NH- tai NH2 -ryhmien välille (tehtävän kuva). Emäsosien koko ja muoto (funktionaalisten ryhmien sijainti) pakottavat ketjut kiertymään. c) DNA ja RNA koostuvat molemmat nukleotideista, joita kummassakin yhdisteessä on neljää eri tyyppiä. DNA:ssa emäksinä ovat adeniini, sytosiini, guaniini ja tymiini, RNA:ssa adeniini, sytosiini, guaniini ja urasiili. RNA:ssa (ribonukleiinihapossa) on hiilihydraattiosana riboosi kun taas DNA:ssa deoksiriboosi.
Liukoisuustulo tarkoittaa liuenneen aineen ionien konsentraatioiden tuloa, jossa on otettu huomioon stoikiometrinen kerroin.
Esimerkki
Kalsiumhydroksidi liukenee
veteen seuraavasti:
(1) Ca(OH)2
![]() Ca2+ + 2
OH–
Ca2+ + 2
OH–
Kalsiumhydroksidin liukoisuustulo (vesiliuoksessa)
KL= [Ca2+ ][OH– ]2
Liukoisuustulon arvo riippuu lämpötilasta.
Koejärjestelyt
Kalsiumhydroksidin liukoisuustulo voidaan
määrittää siten, että valmistetaan aluksi
kylläinen Ca(OH)2-liuos. Liuos dekantoidaan nopeasti.
Kirkkaasta liuoksesta otetaan täyspipetillä 15 - 20 ml:n näyte,
joka titrataan esim. 0,01 M HCl-liuoksella käyttäen indikaattorina
fenoliftaleiinia. Kulutuksen perusteella lasketaan [OH– ].
[Ca2+ ] on puolet siitä. Kylläinen liuos valmistetaan
lisäämällä Ca(OH)2 tislattuun veteen ja
lämmittämällä seosta. Kiinteää faasia täytyy
olla hieman astian pohjalla. Annetaan jäähtyä peitettynä,
jotta ilman CO2 ei pääse reagoimaan
OH–-ionien kanssa:
(2)
CO2 + OH–![]() HCO3–
HCO3–
Tästä
aiheutuu kalsiumkarbonaattien saostumista. Pitkään seisotettaessa
liuoksen Ca2+- ja OH–-ionikonsentraatio siten
muuttuvat.
| V(OH–) | = Ca(OH)2-näytteen tilavuus |
| V(HCl) | = HCl-kulutus |
| c(HCl) | = HCl-liuoksen konsentraatio |
| c(OH–) | = titraustuloksesta laskettu OH–-konsentraatio |

Vrt. Yo 96 k tehtävä 7 ja yo 97 k tehtävä +8
Katalyysi ja katalysaattorit (katalyytit)
Esimerkkejä