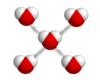
Vesimolekyyli voi muodostaa neljä vetysidosta, koska sen happiatomissa on kaksi vapaata elektroniparia ja happiatomiin on sitoutunut kaksi vetyatomia.
1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Endoterminen reaktio on reaktio, jossa sitoutuu
energiaa (lämpöä). Reaktioentalpia on positiivinen eli
ΔH > 0.
b) Vetysidos on molekyylien välinen tai molekyylien eri osien välinen sidos, jossa vetyatomi on samanaikaisesti sitoutunut kahteen tai useampaan atomiin. Vetysidoksia muodostuu yleisesti silloin, kun vety on liittyneenä fluoriin, happeen tai typpeen. Esim. veden H2O pienimolekyyliselle yhdisteelle korkea kiehumispiste johtuu vesimolekyylien välisistä vahvoista vetysidoksista. Vetysidoksilla on keskeinen merkitys myös DNA:n ja proteiinimolekyylien avaruusrakenteen muovautumisessa.

Vrt.
yo s96 ratkaisun DNA-kuva
Vetysidokset on
merkitty DNA-kuvaan pisteviivalla, jonka alla on alla vihreä
viiva.
c) Pelkistin on aine, joka pelkistää toisen aineen
samalla itse hapettuen. Pelkistin luovuttaa hapettumis-pelkistymisreaktiossa
elektroneja eli sen hapettumisluku kasvaa.
Esimerkiksi reaktiossa
Zn(s) + CuSO4(aq)
→ ZnSO4(aq) +Cu(s)
metallinen sinkki Zn0 toimii pelkistimenä, joka pelkistää Cu2+-ionin metalliseksi kupariksi Cu0 samalla itse hapettuen +2:n arvoiseksi ioniksi. Tehtävän 2. reaktiossa Cl–-ionit pelkistävät Mn4+-ionin Mn2+-:ksi itse hapettuen Cl2:ksi.
d) Allotropia tarkoittaa sitä, että alkuaineella on
samassa olomuodossa rakenteeltaan erilaisia esiintymismuotoja, joissa sidokset
ja atomien järjestys eroavat toisistaan. Allotrooppien fysikaaliset
ominaisuudet poikkeavat toisistaan huomattavasti. Esim. alkuainehiili voi olla
joko grafiittia, timanttia tai fullereenia.
Vrt.
yo s95 tehtävä 7
e) Heterosyklinen yhdiste on orgaaninen rengasrakenteinen yhdiste, jossa renkaaseen sisältyy jokin ns. heteroatomi, tavallisimmin happi, typpi tai rikki. Esimerkiksi tehtävän 3. yhdiste on heterosyklinen.
f) Proteiinit koostuvat peptidisidoksin toisiinsa peräkkäin liittyneistä aminohapoista. Aminohappoketjun aminohappojen järjestys on proteiinin primaarirakenne.
a) Reaktio on hapettumis-pelkistymisreaktio, joten elektronien määrää on hyvä tarkkailla. Kertoimet pystyy kuitenkin määrittämään ilman alustavaa elektronien laskemista.
4 HCl(aq) + MnO2(s) → 2 H2O (l) + MnCl2(aq) + Cl2(g)
Kaksi Cl–-ioneista hapettuu, jolloin ionit menettävät yhteensä kaksi elektronia. Mangaanin hapettumisluku muuttuu +4:stä +2:ksi, mihin tarvitaan nämä kaksi elektronia.
b) M(MnO2) = 86,94 g/mol ja
M(Cl2) = 70,90 g/mol
Koska molempien
lähtöaineiden määrä on ilmoitettu, lasketaan niiden
ainemäärät:
n(HCl) = 0,00555 l · 0,102
M = 5,5661 · 10–3 mol
n(MnO2) = 0,222 g : 86,94 g/mol = 2,5535
· 10–3 mol
HCl :n ainemäärä on
reaktioyhtälön mukaan laskien liian pieni, jotta kaikki
MnO2 reagoisi. Syntyvän Cl2:n määrä
riippuu siten HCl :n ainemäärästä:
n(Cl2) = 5,5661 · 10–3 mol : 4 ja m(Cl2)
= (5,5661 · 10–3 mol : 4 ) · 70,90
g/mol
V(Cl2) = 5,5661 ·
10–3 mol : 4 · 70,90 g/mol : 3,17
g/l = 0,0317 l = 31,7 ml
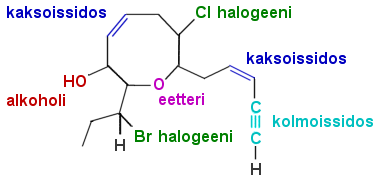
a) Yhdisteessä on kaksi kaksoissidosta, yksi kolmoissidos, alkoholihydroksyyli, eetterihappi sekä halogeenit kloori ja bromi.
b) Additioreaktio tapahtuu helpoiten kolmoissidokseen, johon voi liittyä esim. HCl. Esteröityminen tapahtuu OH-ryhmän kanssa, esim. etikkahappoanhydridillä saadaan etikkahapon CH3COOH esteri.
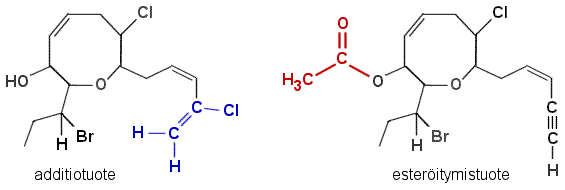
Huom. Pelkästään tuotteiden rakennekaavat riittävät b-kohdassa. Reagensseja ei tarvitse mainita. Liittymisreaktiotuote voi olla muukin, esim. veden liittyessä syntyvä alkoholi tai bromaustuote. Esteröitymistuote voi samoin olla jokin muukin, tai se voidaan kirjoittaa myös käyttäen hyväksi karboksyylihapon RCOOH yleistä esitystapaa. Epäorgaaniset hapotkin muodostavat estereitä.
a) Kaliumnitraatti liukenee veteen helposti ioneiksi, jotka kuljettavat sähköä.
b) Kloori on bromia elektronegatiivisempi, joten se riistää bromilta elektroneja. Kloori siis pystyy hapettamaan bromin.
c) Amiinissa typpiatomilla on vapaa elektronipari, johon protoni voi sitoutua. Reaktio on esitetty tässä primaariselle amiinille, mutta se tapahtuu vastaavasti sekundaariselle ja tertiaariselle amiinille.
d) Muurilaastiseoksessa on sammutettua kalkkia Ca(OH)2, joka reagoi ilman hiilidioksidin kanssa muodostaen kovaksi kiteytyvää karbonaattia:
Dikarboksyylihappo on R(COOH)2.
Kahdesta
COOH-ryhmästä kertyy moolimassaa yhteensä 2 · (12
+16 +16 +1) g/mol = 90 g/mol, joten R:n osuudeksi jää 116 g/mol
– 90 g/mol = 26 g/mol.
M(C2H2) = 2
· (12 + 1) g/mol = 26 g/mol
Hapon molekyylikaava on siten
C2H2(COOH)2 = C4H4O4
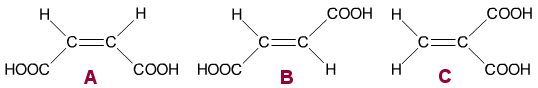
Mahdollisia rakennekaavoja on kolme. Yhdisteet A ja C ovat poolisia, koska molemmat pooliset COOH-ryhmät sijaitsevat niissä molekyylin toisella laidalla. Yhdiste B on (lähes) pooliton, koska COOH-ryhmät sijoittuvat molekyylin vastakkaisiin päihin.
a) Reaktioyhtälö
| Aine | c alussa | c tasapainossa | Yksikkö |
| N2O4 | 2,50 | 2,50 – 2,20 = 1,40 | M |
| NO2 | 0 | 2,20 | M |
K = [NO2]2 : [N2O2] = (2,20 M)2 : 1,40 M = 3,46 M
b) Kun tasapainoseokseen lisätään 1,20 mol NO2, uusi tasapaino siirtyy lähtöaineen
suuntaan.
| Aine | c alussa | c tasapainossa | Yksikkö |
| N2O4 | 1,40 | 1,40 + 0,5x | M |
| NO2 | 2,20 + 1,20 = 3,40 | 3,40 – x | M |
K = [NO2]2 :
[N2O4] = (3,40 – x)2 :
(1,40 + 0,5x) = 3,46 (M:t pois jättäen)
x2 – 6,80x + 11,56 = 3,46 ·
1,40 + 3,46 · 0,5x
x2 – 8,53
x + 6,716 = 0
x = 0,88 M (vain pienempi juurista kelpaa)
[NO2] = 3,40 M – 0,88 M = 2,52 M
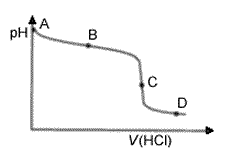
a) Ammoniakin konsentraatio on suurin heti titrauksen alussa pisteessä A, koska ammoniakkia ei vielä ole lainkaan neutraloitu.
b) Ammoniumionin konsentraatio on suurin titrauksen
päätepisteessä C (ekvivalenttikohdassa), koska tällöin
kaikki ammoniakki on reagoinut (mutta liuostilavuus ei vielä ole niin
suuri kuin esim. pisteessä D):
NH3(aq) + HCl(aq)
![]() NH4+(aq) + Cl–(aq)
NH4+(aq) + Cl–(aq)
c) Liuos on puskuriliuos kohdassa B, jossa jäljellä olevan ammoniakin konsentraatio on yhtä suuri kuin titrauksessa muodostuneiden ammoniumionien. Kyseessä on heikon emäksen NH3 ja sen suolan NH4Cl (varsinaisesti ammoniumionin, joka voi toimia happona) muodostama puskurisysteemi, jonka pH on lievästi emäksisellä puolella.
Huom. Pisteessä D liuos ei ole puskuroitu, vaikka titrauskäyrässä on loiva tasannemainen osa kuten pisteen B ympäristössäkin. Tällä alueella liuoksessa on ylimäärin vahvaa happoa ja vähemmän heikkoa happoa NH4+. Liuoksen pH laskee hitaasti, koska liuokseen lisätään happoa vähän kerrallaan ja kaikki vahva happo on täysin protolysoitunut.
d) Pisteessä C liuos on lievästi hapan, koska heikkoa
emästä titrataan vahvalla hapolla. Ammoniumionit hydrolysoituvat ja
reaktiossa syntyy oksoniumioneja:
NH4+(aq) +
H2O ![]() NH3(aq) + H3O+(aq)
NH3(aq) + H3O+(aq)
Vastaukseen voi sisällyttää esim. seuraavia menetelmiä: suodatus, saostus, tislaus, sublimointi, uuttaminen, kiteytys, kromatografiat, elektroforeesi.
Menetelmästä kuvataan käytännön toteutus, kemiallis-fysikaaliset perusteet ja menetelmän rajoitukset sekä esimerkkejä käyttötilanteesta. Kaksi tai kolme menetelmää voi valita tarkemman käsittelyn kohteeksi.