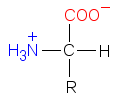
 Kahtaisioni on aminohappomolekyyli, jossa
aminoryhmä –NH2 on protonoitunut muotoon
–NH3+ ja karboksyyliryhmä –COOH
deprotonoitunut muotoon –COO–. Molekyylin toisessa
päässä on siis positiivinen ja toisessa negatiivinen
varaus.
Kahtaisioni on aminohappomolekyyli, jossa
aminoryhmä –NH2 on protonoitunut muotoon
–NH3+ ja karboksyyliryhmä –COOH
deprotonoitunut muotoon –COO–. Molekyylin toisessa
päässä on siis positiivinen ja toisessa negatiivinen
varaus.1 | 2 | 3 | 4 | 5 | 6 | 7 | +8 | kysymykset (erilliseen selainikkunaan)
a) Alkuaine on täsmällisimmin määriteltävissä atomin rakenteen perusteella: alkuaineen kaikilla atomeilla on sama järjestysluku ts. niiden ytimessä on sama määrä protoneja. (Joskus alkuainetta on ollut tapana kuvata myös siten, että se on aine, jota ei kemiallisin keinoin pystytä jakamaan pienempiin osiin.)
b) Kemiallinen yhdiste muodostuu kahden tai useamman eri alkuaineen atomien liittyessä yhteen kemiallisin sidoksin. Esimerkiksi kahdesta vetyatomista ja yhdestä happiatomista muodostuva vesi H2O tai NaCl, joka koostuu Na+- ja Cl–-ioneista niiden liittyessä toisiinsa hilarakenteeksi, jonka koko voi vaihdella mutta joka on ulospäin sähköisesti neutraali.
c) Molekyyli on kahdesta tai useammasta atomista muodostunut hiukkanen. Molekyylissä atomit liittyvät toisiinsa yhteisten elektronien avulla (kovalenttinen sidos). Molekyylissä voi olla kymmeniä ja jopa satoja tuhansia atomeja. Jotkin alkuaineet esiintyvät molekyyleinä, joissa on kaksi tai useampia saman alkuaineen atomia.
d)
 Kahtaisioni on aminohappomolekyyli, jossa
aminoryhmä –NH2 on protonoitunut muotoon
–NH3+ ja karboksyyliryhmä –COOH
deprotonoitunut muotoon –COO–. Molekyylin toisessa
päässä on siis positiivinen ja toisessa negatiivinen
varaus.
Kahtaisioni on aminohappomolekyyli, jossa
aminoryhmä –NH2 on protonoitunut muotoon
–NH3+ ja karboksyyliryhmä –COOH
deprotonoitunut muotoon –COO–. Molekyylin toisessa
päässä on siis positiivinen ja toisessa negatiivinen
varaus.
e) Atseotrooppisen seoksen komponentit eivät erotu tislattaessa vaan seos kiehuu vakiolämpötilassa. Esimerkiksi etanoli ja vesi muodostavat atseotrooppisen seoksen, samoin typpihappo ja vesi.
f) Raseeminen seos sisältää optisesti aktiivisia D- ja L-isomeerejä yhtä paljon, joten se ei itse ole optisesti aktiivinen.
Ilmeniitin pelkistysreaktion yhtälö
m(FeTiO3) = 0,054 · 55 000 g
n(FeTiO3) = n(H2O) = 0,054 ·
55 000 g : 151,7 g/mol
Vettä syntyy siis
m(H2O) = 18,02 g/mol · 0,054 · 55
000 g : 151,7 g/mol = 353 g.
Syntyvän hapen ainemäärä on puolet veden
ainemäärästä, joten happea vapautuu
m(O2) = 32,00 g/mol · 0,054
· 55 000 g : 151,7 g/mol : 2 = 313 g.
a) Ruokaetikka (etikkahapon CH3COOH vesiliuos) ja öljy eivät liukene tosiinsa, koska öljyn molekyylit ovat poolittomia ja siten hydrofobisia. Ravistelemalla saadaan syntymään emulsio, jossa ruokaetikka on pieninä pallosina öljyssä, mutta emulsio ei ole pysyvä. Seoksessa palloset ja öljyn molekyylit ovat koko ajan liikkeessä, joten vähitellen samanlaiset kohtaavat toisensa ja muodostavat selkeästi erottuvan faasin.
b) Suola NaCl liukenee ioniyhdisteenä paremmin ruokaetikkaan, joka on vesiliuos ja sisältää poolisia molekyylejä sekä protolyysissä syntyneitä ioneja, kuin poolittomia molekyylejä sisältävään öljyyn.
c) Koska öljy liukenee huonosti veteen,
pöytäliinan peseminen ei onnistu puhtaalla vedellä.
Saippualiuoksen anionien hydrofobiset päät sen sijaan pystyvät
vetämään puoleensa öljyn poolittomia molekyylejä ja
siten irrottamaan ne pöytäliinan kuiduista sekä sitomaan
(emulsioon liuoksen kationien ympärille) pieniksi pallosiksi, jotka
huuhtoutuvat vedellä pois.
Vrt. yo96s tehtävä 1 a
a) (He, helium) ei muodosta yhdisteitä, koska se on jalokaasu, jonka uloin elektronikuori on täysin miehitetty.
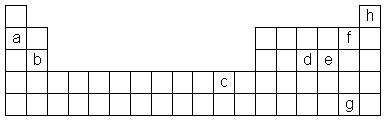 b) b (Mg, magnesium) muodostaa yhdisteitä
+2:n arvoisena kationina, koska sen uloimmalla kuorella on kaksi elektronia,
jotka irtoavat herkästi, jolloin edellinen täysin miehitetty kuori
jää uloimmaksi. Myös c (Cu, kupari) esiintyy
yhdisteissään usein +2:n arvoisena ionina. Se on siirtymäryhmiin
kuuluva metalli, jonka uloimmalla elektronikuorella on yksi elektroni ja jonka
toiseksi uloimman 3. kuoren d-elektronien energiataso on lähellä 4
s-elektronin energiatasoa.
b) b (Mg, magnesium) muodostaa yhdisteitä
+2:n arvoisena kationina, koska sen uloimmalla kuorella on kaksi elektronia,
jotka irtoavat herkästi, jolloin edellinen täysin miehitetty kuori
jää uloimmaksi. Myös c (Cu, kupari) esiintyy
yhdisteissään usein +2:n arvoisena ionina. Se on siirtymäryhmiin
kuuluva metalli, jonka uloimmalla elektronikuorella on yksi elektroni ja jonka
toiseksi uloimman 3. kuoren d-elektronien energiataso on lähellä 4
s-elektronin energiatasoa.
c) Epämetalli d:n (P:n, fosforin) oksidi on hapan.
P4O10 + 6 H2O
→ 4
H3PO4
Myös
epämetallit e (S), f (F) jag (I) muodostavat happamia oksideja.
d) Metalli a:n (Li:n, litiumin) oksidi on
emäksinen. Li2O + H2O
→ 2 LiOH
Myös metalli b:n (Mg) oksidi on emäksinen. Alkuaine c:lläkin
(Cu) on emäksinen oksidi.
e) Voimakkain hapetin on f (F, fluori). Fluori on vahvasti elektronegatiivinen ja muodostaa herkästi F–-anionin riistämällä elektronin joltakin toiselta aineelta uloimman kuoren 7:n elektroninsa täydennykseksi.
A ja B reagoivat keskenään seuraavasti:
Yhdisteen C alkuainekoostumuksesta ja moolimassasta päätellään (ajatellaan esim. 100 g:n näytettä, jolloin prosenttiluvut vastaavat kunkin alkuaineen massaa grammoina ja jaetaan massojen mittaluvut alkuaineen moolimassojen mittaluvuilla):
| C | H | O |
| 72,0 % | 6,7 % | 21,3 % |
| 72,0 : 12,01 = 6,0 | 6,7 : 1,00 = 6,7 | 21,3 : 16,0 = 1,33 |
| 4,5 | 5 | 1 |
| 9 | 10 | 2 |
Jaetaan l3. rivin tulokset 1,33:lla (pienimmällä) .
Kokonaislukuihin päästään laventamalla 4. rivin luvut
2:lla. Lasketaan moolimassa aluksi pienimmillä
kertoimilla.
M(C9H10O2) = 150 g/mol
(siis alle 160 g/mol).
Koska reaktiossa lohkeaa vettä ja tuotteessa C on kaksi happiatomia, päätellään, että kyseessä on esteröitymisreaktio. Reaktiossa yhdiste A voi olla joko karboksyylihappo tai alkoholi (tai fenoli). (Yhdiste A on aromaattinen, joten myös yhdiste C on aromaattinen.)
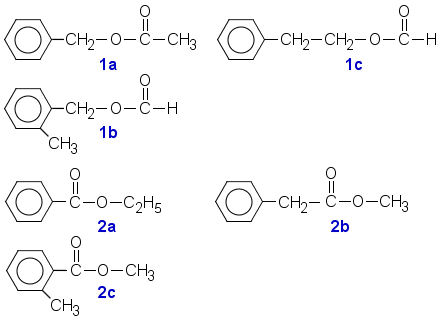
Esterit 1a -1c ovat syntyneet aromaattisesta alkoholista (A) ja karboksyylihaposta (etikkahappo tai muurahaishappo, B). Yhdiste 1b on o-isomeeri, myös m- ja p-isomeerit kuuluvat mukaan.
Esterit 2a - c ovat syntyneet aromaattisesta karboksyylihaposta (A) ja alkoholista (etanoli tai metanoli B). Yhdisteellä 2c on m- ja p-isomeerit.
Muurahaishapon protolyysireaktio:
| Aine | c alussa | c tasapainossa | Yksikkö |
| HCOOH | 1,5 · 10 –3 | 1,5 · 10 –3 – x | mol/l |
| HCOO– | 0 | x | mol/l |
| H3O+ | 0 | x | mol/l |
Ka = x2 : (1,5
· 10 –3 – x) = 1,6 ·
10 –4
x = 4,16 · 10
–4
Formiaatti- ja oksoniumionien lisäksi liuoksessa on
hyvin pieni määrä hydroksidi-ioneja, joiden konsentraatio
lasketaan veden ionitulon avulla.
Kw = [H
3O+][OH–] = 4,16 · 10
–4 · [OH–] = 1,00 ·
10 –14 (Yksiköt jätetty pois tästä.)
[OH– ] = 2,4 · 10 –11
mol/l
[HCOO– ] = 4,2 · 10
–4 mol/l
[H 3O+] = 4,2 ·
10 –4 mol/l
[OH– ] = 2,4
· 10 –11 mol/l
Huom. Liuos
on tietysti sähköisesti neutraali, eli positiivisia ja negatiivisia
ioneja on yhtä paljon. [OH–] on vain niin pieni
verrattuna toisten ionilajien konsentraatioon, että konsentraatioiden
arvojen tarkkuuden rajoissa sen vaikutus ei näy. Sen laskeminen on hieman
turhaa, mutta se vaadittiin oikeaan ratkaisuun.
Liuoksesta saadaan puskuriliuos lisäämällä muurahaishapon emäksistä suolaa esim. HCOONa tai HCOOK. (Koska NaOH ja KOH ovat myös suoloja, voitaisiin liuos muuttaa puskuriliuokseksi lisäämällä jompaa kumpaa noin puolet neutralointiin tarvittavasta määrästä. Puskuriliuoksia valmistettaessa näin ei kuitenkaan yleensä menetellä.)
a) Natrium pelkistää vetyä vedestä:
Demonstraatiossa ei pidä käyttää kovin suurta määrää natriumia, koska reaktio on eksoterminen ja nopea, joten muodostuva vety voi syttyä räjähdysmäisesti palamaan. Myös roiskeet ovat mahdollisia avointa reaktioastiaa käytettäessä. Suojalevy on tarpeen. Vettä on oltava runsaasti ylimäärin. Jos käytetään kaasunkeräysastiaa, vety voidaan todeta palamiskokeella (haukahtava ääni). Veteen kannattaa lisätä fenoliftaleiinia indikaattoriksi. Sen punainen väri osoittaa hydroksidi-ionien muodostumisen. Usein toimitaan siten, että pieni natriummetallin pala pannaan suurehkoon vesiastiaan (iso keitinlasi tai pneumaattinen amme). Palanen vaeltelee ympäri astiaa punainen vana perässään.
b) Demonstraatio perustuu kaksoissidokselle tyypilliseen additioreaktioon. Hiilivetyjä sisältäviin koeputkiin lisätään hieman bromivettä (Br2) tai kaliumpermanganaatin (KMnO4) laimeaa vesiliuosta. Alkeenin reaktion seurauksena bromin ruskea tai permanganaatin violetti väri häviää. Alkaaneja sisältävässä koeputkessa väri säilyy. Ravisteltaessa koeputket on pidettävä kumitulpalla suljettuina. Kädet on hyvä suojata hansikkain. Koeputkia ei saa täyttää liian täyteen, noin 3/4 putkesta on hyvä jättää tyhjäksi. Demonstraation jälkeen putket tyhjennetään orgaanisille liuottimille varattuun jäteastiaan, ei viemäriin.
c) Katalyytin vaikutusta reaktion nopeuteen on helppoa havainnollistaa pienillä ainemäärillä piirtoheittimen avulla. Kahteen petrimaljaan (tai muuhun tasapohjaiseen lasiastiaan) pannaan yhtä paljon (= yhtä vähän!) laimeahkoa vetyperoksidin (H2O2) vesiliuosta. Molempiin maljoihin alkaa muodostua hetken kuluttua pieniä kuplia, jotka osoittavat vetyperoksidin hajoavan hapeksi ja vedeksi. Toiseen maljaan ripotellaan hieman hienojakoista mangaanidioksidia MnO2, jolloin vetyperoksidin hajoaminen kiihtyy ja kuplia muodostuu nopeasti (kuohuu). Maljojen sisällön voi huuhtoa runsaalla vedellä viemäriin, mutta käsille on aineita varottava roiskuttamasta, sillä vetyperoksidi on laimeanakin liuoksena hieman syövyttävää.
Vastaukseen tulisi sisällyttää korroosioilmiön selitys ja esimerkkejä sekä korrodoutisesta että sen estosta.
Korroosiolla tarkoitetaan ilmiöitä, joissa metalli tai metalliseos altistuu hapettumiselle ja osittain hapettuu ilman tai muiden kaasujen ja liuosten vaikutuksesta.
Korroosio voi olla kosteaa (liuoksen vaikutus) tai kuivaa (kuivien kaasujen vaikutus). Kuiva korroosio on harvinaisempaa ja sitä esiintyy erikoisolosuhteissa, sillä ilman kanssa kosketuksiin joutuva metallipinta on aina tekemisissä myös kosteuden kanssa.
Metallien jännitesarjasta (jaloudesta vs. epäjaloudesta) voidaan osittain päätellä metallin alttius korroosioon, mutta ei täysin, sillä olosuhteet vaikuttavat metallin hapettumiseen. Korroosiota edistää hapen lisäksi kosketus elektrolyyttiliuokseen.
Esimerkki
Korroosioalttius merivedessä: Mg,
Zn, Al, Fe, Pb, Sn, Cu, Ni, ruostumaton teräs, Ag, Au
Esimerkki
Suojaava oksidikerros
Jotkin
epäjalot metallit, mm. Al, Zn, Cr, Ti, muodostavat pintaansa tiiviin
oksidikerroksen, joka suojaa metallirakenteen sisempiä osia korroosiolta.
Metallin sanotaan tällöin passivoituvan. Ilman suojakerrosta alumiini
hapettuu herkästi ja syttyy jopa palamaan suhteellisen helposti. Raudan
oksidikerros, ruoste, puolestaan on huokoinen ja epäyhtenäinen ja
pikemminkin edistää korroosiota keräämällä
huokosiin vettä ja elektrolyyttejä.
Esimerkki
Patina
Ilman CO2 reagoi
kosteuden ja joidenkin metallien kanssa muodostaen hydroksidi- ja
karbonaattiyhdisteitä, joita sanotaan patinaksi ja jotka hidastavat
korroosion etenemistä. Tällaisia metalleja ovat Cu, Pb ja Zn. Kuparin
ja pronssin patina on pääosin vihreää emäksistä
Cu2(OH)2CO3:a, mutta joukossa voi olla
sulfaattejakin.
 |
Raudan
ruostuminen Kuva a: raudan hapettuminen tapahtuu kohdassa, jossa ilman happi pääsee kosketukseen raudan pinnan ja kosteuden kanssa. Metallipinta toimii anodina. Kuva b: Fe 2+ hapettuu edelleen Fe3+:ksi, joka muodostaa hapen ja veden kanssa ruostetta (Fe2O3 · H2O). |
Kannattanee myös mainita, ettei korroosiota voida kokonaan estää, mutta sitä pystytään kuitenkin huomattavasti hidastamaan
Myös jalometallien korroosiota tai korroosionkestävyyttä on hyvä käsitellä vastauksessa.