Luettelossa on 21 tehtävää, useimmat laskuja. Titrausta käsitteleviä tehtäviä ovat k97 jokeri, s97 kokeellinen tehtävä, k00 tehtävä 7, k03 tehtävä 5, k05 tehtävä 4 ja k06 tehtava 9.

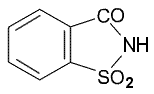
Makeutusaineena usein käytettävä sakkariini
(kuva) on heikko happoa (Ka =

a) Kuinka monta grammaa pyridiiniä (kuva)
tarvitaan valmistettaessa 0,10 litraa vesiliuosta, jonka pH
lämpötilassa 25 °C on 8,70? b) Kun pyridiini reagoi
typpihapon kanssa, muodostuu pyridiniumnitraattia
pyH+NO3–. Päättele, onko
tämän suolan vesiliuos hapan, neutraali vai emäksinen. Pyridiini
on heikko emäs, jonka emäsvakion arvo on Kb =
Vesiliuos sisältää tuntemattoman
määrän vetykloridia. Suunnittele kokeellinen menetelmä,
jonka avulla voidaan tarkasti saada selville liuoksessa olevan vetykloridin
määrä. Kuvaa yksityiskohtaisesti valitsemaasi tapaa, sen
kemiallista perustaa ja tarvittavia koejärjestelyjä.
Ratkaisu
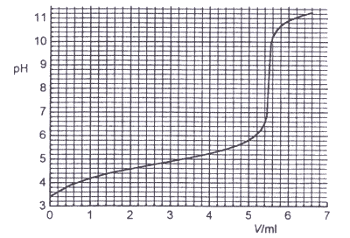
Kun erään yksiarvoisen hapon vesiliuoksesta
otettu 25,0 ml:n näyte neutraloitiin 0,10 M NaOH-liuoksella saatiin
oheinen titrauskäyrä. a) Mikä oli hapon konsentraatio
alkuperäisessä liuoksessa? b) Titrauksen päätepiste
todettiin suoran pH-mittauksen lisäksi myös
happo-emäsindikaattorinavulla. Mihin happo-emäsindikaattorien
toiminta perustuu , ja mitä seikkoja tuli ottaa huomioon indikaattorin
valinnassa? c) Määritä hapon happovakion arvo. d)
Työssä käytetty pH-mittari kalibroitiin liuoksella, jonka pH on
4,74. Liuos valmistettiin lisäämällä 0,10 M NaOH-liuosta
20,0 ml:aan 0,10 M etikkahappoa (Ka =
Analyysia varten tarvitset konsentraatioltaan tarkoin tunnettua NaOH-liuosta. Käytössäsi on vaaka, tarvittavat mitta-astiat, pH-mittari, tislattua vettä, 0,200 M HCl-liuosta ja NaOH-rakeita. Kiinteä natriumhydroksidi on hygroskooppinen aine, jonka tarkkaa määrää ei saada selville punnitsemalla. Mittaliuoksia valmistettaessa liuoksen NaOH-konsentraatio joudutaan tällöin tarkistamaan erillisellä määrityksellä. Selvitä yksityiskohtaisesti, miten valmistat 250 ml noin 0,1 M NaOH-liuosta ja millä tavoin saat selville tarkan konsentraation.
Kun 82,9 mg erästä heikkoa yksiarvoista happoa
liuotetaan 250 ml:aan vettä saadaan liuos, jonka pH on 2,78. Hapon
happovakion arvo on Ka =
Erään yksiarvoisen hapon HA vesiliuoksen pH on
2,34. Kuinka suuri tilavuus vettä on lisättävä 15 ml:aan
tätä happoliuosta, jotta pH nousee arvoon 3,34? Tarkastele erikseen
tapauksia, kun a) HA on vahva happo, b) HA on heikko
happo, jonka happovakio Ka =
Muurahaishappo, HCOOH, on heikko yksiarvoinen happo, jonka
happovakio Ka =
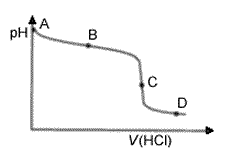
Kun ammoniakin vesiliuosta titrattiin suolahapolla, saatiin oheisen
kuvan titrauskäyrä. Valitse pisteistä A - D se,
jossa
a) ammoniakin konsentraatio on suurin,
b)
ammoniumionin konsentraatio on suurin,
c) liuos on puskuriliuos.
d) Onko liuos pisteessä C hapan, neutraali vai emäksinen?
Perustele kussakin tapauksessa vastauksesi.
Nykyisin yleisessä käytössä olevan happo-emäs-määritelmän esitti tanskalainen kemisti Johannes Brønsted vuonna 1923.
Ammoniakki on veteen runsasliukoinen heikko emäs, jonka
emäsvakion arvo lämpötilassa 25°C on Kb =
Typpihapoke on heikko happo, joka protolysoituu vedessä seuraavasti:
a) Kuinka monta prosenttia haposta protolysoituu
nitriitti-ioneiksi, kun 0,10 moolia typpihapoketta liuotetaan veteen 1,0
litraksi liuosta? b) Miten liuoksen pH muuttuu, kun liuokseen
lisätään natriumnitriittiä? Perustele. Typpihapokkeen
happovakio
Sitruunasta puristetun mehun pH on noin 2. Happamuus johtuu
pääasiassa mehussa olevasta sitruunahaposta.
a) Miten
sitruunamehun pH muuttuu, kun mehuun lisätään sokeria?
b) Miten sitruunamehun pH muuttuu, jos sokerin asemesta
käytetään synteettistä makeutusainetta sakariinia?
Sakariini on hyvin heikko happo, joka lisätään mehuun hapon
natriumsuolana.
c) Sitruunamehua lämmitetään
avoimessa astiassa. Onko astiasta nouseva höyry hapanta, neutraalia vai
emäksistä?
Perustele kaikkien kohtien vastaukset.
Magnesiumin valmistuksessa tarvittavaa
lähtöainetta, magnesiumhydroksidia, saadaan merivedestä, josta
Mg(OH)2 saostetaan kalsiumhydroksidin avulla. Kuinka monta grammaa
magnesiumhydroksidia saostuu, kun 150 litraan merivettä
lisätään kiinteää kalsiumhydroksidia, kunnes liuoksen
pH = 9,70? meriveden magnesiumionipitoisuus on 1,34 g/l. Magnesiumhydroksidin
liukoisuustulo
Oheisessa kuvassa on kaksi titrauskäyrää, joista toinen kuvaa etikkahapon ja toinen typpihapon titrausta natriumhydroksidiliuoksella.

| a) | Kumpi käyristä esittää typpihapon titrausta? |
| b) | Kummassa titrauksessa muodostuu puskuriliuos? |
| c) | Miksi titrausten ekvivalenttikohtien pH-arvot eroavat toisistaan? |
| d) | Miksi titrauskäyrät yhtyvät ekvivalenttikohdan jälkeen? |
| Perustele kaikki vastauksesi. |
Heikon yksiarvoisen hapon liuos valmistettiin punnitsemalla 2,50 millimoolia happoa ja laimentamalla liuos tilavuuteen 250 ml. Sähkönjohtokyvyn perusteella voitiin laskea, että 7,64 % haposta oli protolysoitunut. Määritä hapon happovakion arvo ja laske liuoksen pH.
Kun 0,500 litraan 0,400 M HCl-liuosta lisättiin 2,00 g magnesiummetallia, tapahtui voimakas kaasunmuodostusreaktio ja astia lämpeni selvästi. a) Laadi reaktion yhtälö. b) Onko reaktio endo- vai eksoterminen? c) Mikä on liuoksen pH reaktion jälkeen?
Yksiarvoista heikkoa happoa titrataan natriumhydroksidilla lämpötilassa 25 °C. Vastaa (oikein/väärin) väitteisiin, joiden mukaan titrauksen ekvivalenttikohdalla on voimassa:
Oheisessa kuvassa on esitetty veden ionitulon arvo eri lämpötiloissa.
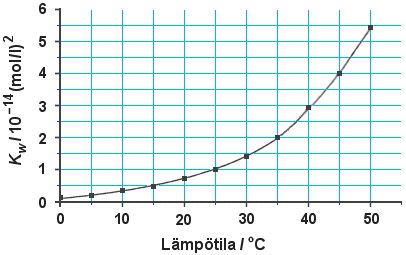
a) Mitä tarkoitetaan veden
ionitulolla?
Määritä kuvion perusteella:
b) puhtaan
veden pH lämpötilassa
c)
hydroksidi-ionin konsentraatio lämpötilassa
d) onko veden autoprotolyysi endo-
vai eksoterminen reaktio? Perustele vastauksesi.
Säilönnässä ja mausteena käytettävä väkiviinaetikka on koostumukseltaan laimeaa etikkahappoliuosta. Etikkahapon tarkan pitoisuuden määrittämiseksi väkiviinaetikasta otettiin 25,0 ml:n näyte, joka titrattiin 0,194 M NaOH-liuoksella. Ennen titrauksen aloittamista näyte laimennettiin vedellä noin 100 millilitraksi. Titraukset on koottu alla olevaan taulukkoon:
| V(NaOH)/ml | 0 | 1,0 | 2,0 | 4,0 | 6,0 | 7,0 | 8,0 | 8,5 | 10,0 | 14,0 |
| pH | 2,9 | 4,0 | 4,3 | 4,7 | 5,2 | 5,5 | 6,4 | 11,2 | 12,0 | 12,4 |
| a) | Piirrä titrauskäyrä. Käytä pystyakselina liuoksen pH:ta ja vaaka-akselina NaOH-kulutusta. Merkitse ekvivalenttikohdan sijainti kuvaan ja määritä sen perusteella etikkahapon pitoisuus (g/l) väkiviinaetikassa. (3 p.) |
| b) | Miksi laimennuksessa saadun liuoksen tarkkaa tilavuutta ei tarvitse tietää? (1 p.) |
| c) | Titrauksen päätepiste voidaan todeta myös happo-emäsindikaattoria käyttäen. Mitä seikkoja tulee indikaattoria käytettäessä ottaa huomioon? Ehdota jotain titraukseen sopivaa indikaattoria. (2 p.) |
0,50 litrassa liuosta on 1,0 millimoolia suolahappoa
(vetykloridia) lämpötilassa
| a) | Mikä on liuoksen pH? (1 p.) |
| b) | Mihin tilavuuteen liuos on laimennettava, jotta sen pH olisi 3,00? (2 p.) |
| c) | Kuinka suuri tilavuus 0,10 M NaOH-liuosta on lisättävä alkuperäiseen suolahappoliuokseen, jotta muodostuvan liuoksen pH olisi 12,00? (3 p.) |