Luettelossa on 20 tehtävää. Tehtävissä on sekä laskuja (liukoisuustasapaino, tasapainoreaktiot) että essee-tehtäviä. Parissa kokeellisessa tehtävässä on kyse esteröitymisestä, joten ne on otettu mukaan tähän kategoriaan, vaikka niissä tasapainoa sinänsä ei tarvitse laajemmin käsitellä.
16.5.2007

a) Kylläisessä liuoksessa vallitsee dynaaminen tasapaino kiinteän aineen ja liuoksen välillä. Selvitä, mitä tällä dynaamisella tasapainolla tarkoitetaan. b) Miten lyijy(II)kloridin liukeneminen veteen eroaa kemiallisesti jodin liukenemisesta?
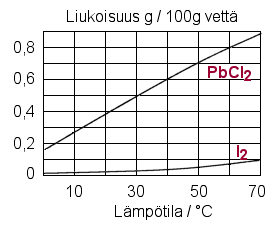
Vastaa viereisen kuvion avulla seuraaviin kysymyksiin:
c) Liukeneeko 0,3 grammaa lyijy(II)kloridia 50 millilitraan
vettä lämpötilassa
d)
Lämpeneekö liuos vai jäähtyykö se, kun jodi liukenee
veteen?
e) Mikä on lyijy(II)kloridin liukoisuustulon arvo
lämpötilassa 50 °C?
Le Châtelier'n periaate ja sen soveltaminen erilaisissa kemiallisissa systeemeissä.
Mitä tarkoitetaan aineen liukoisuustulolla? Valitse jokin veteen niukkaliukoinen yhdiste ja suunnittele menetelmä, jonka avulla sen liukoisuustulon arvo voidaan määrittää kokeellisesti. Selosta koejärjestelyt ja tuloksen saamiseksi tarvittavat laskutoimitukset.
a) Magnesiumhydroksidin liukoisuustulo on
KL = 1,1 · 10–11
(mol/l)3. Muodostuuko saostumaa, kun
Tarkoituksesi on valmistaa etyyliasetaattia käyttämällä hyväksi esteröitymisreaktiota. Esitä reaktioyhtälö, johon aineen valmistus perustuu, ja selvitä, miten synteesi voidaan tehdä laboratoriossa. Miten voit todeta, että saamasi tuote on oikea?
Esteröityminen on tasapainoreaktio. Tasapainon muodostuminen on otettava huomioon synteesissä.
Metanolia voidaan valmistaa hiilimonoksidin ja vedyn välisen tasapainoreaktion avulla:
a) Perustele, miksi tässä reaktiossa on edullista
käyttää katalyyttiä, matalaa lämpötilaa ja suurta
painetta. b) Kun 10,0 litran astiaan suljettiin 2,0 moolia
hiilimonoksidia ja 1,0 moolia vetykaasua lämpötilassa 500 °C,
muodostui astiaan tasapainotilan asetuttua 0,18 moolia metanolia. laske
reaktion tasapainovakion arvo.
Ratkaisu
Kloroformiliuoksessa dityppitetroksidi hajoaa reaktion
N2O4
![]() 2 NO2
2 NO2
mukaisesti. Kun 2,50 moolia N2O4 lisättiin 1,00 litraan kloroformiliuosta, muodostui astiaan tasapainon asetuttua 2,20 mol NO2. a) Laske reaktion tasapainovakion arvo. b) Tähän tasapainoseokseen lisättiin 1,20 mol NO2. Mikä oli typpidioksidin konsentraatio liuoksessa, kun tasapainotila jälleen asettui?
Ammoniakin valmistus typestä ja vedystä
on teollisesti tärkeä tasapainoreaktio. Astiaan, jonka tilavuus on 1,0 l suljettiin 25 mmol typpeä ja 99 mmol vetyä. a) Mikä on reaktion tasapainovakion arvo ko. lämpötilassa, kun tasapainon asettuessa astiaan muodostui 24 mmol NH3? b) Astian tilavuutta muutettiin siten, että ammoniakin ainemäärä tasapainon jälleen asettuessa oli 30 mmol. Mikä oli astian uusi tilavuus?
Korkeassa lämpötilassa reaktion
tasapainovakio K = 0,090. a) Osoita, että reaktion tasapainotila on riippumaton reaktioastian tilavuudesta. b) Tapahtuuko reaktio etenevään vai käänteiseen suuntaan, kun 1,0 g typpeä, 1,0 g happea ja 1,0 g typpimonoksidia saatetaan reagoimaan keskenään? c) 0,25 litran astiaan suljettiin 1,0 g happea, 1,0 g typpeä ja 1,0 g typpimonoksidia. Mikä oli astiassa olevan kaasuseoksen tiheys, kun tasapaino oli asettunut?
Magnesiumin valmistuksessa tarvittavaa
lähtöainetta, magnesiumhydroksidia, saadaan merivedestä, josta
Mg(OH)2 saostetaan kalsiumhydroksidin avulla. Kuinka monta grammaa
magnesiumhydroksidia saostuu, kun 150 litraan merivettä
lisätään kiinteää kalsiumhydroksidia, kunnes liuoksen
pH = 9,70? meriveden magnesiumionipitoisuus on 1,34 g/l. Magnesiumhydroksidin
liukoisuustulo
Mitä tarkoitetaan a) magnesiumhydroksidin liukoisuudella veteen, b) magnesiumhydroksidin liukoisuustulolla? c) Kuvaa jotain tapaa, jolla voit kokeellisesti määrittää magnesiumhydroksidin liukoisuustulon arvon.
Kemiallinen tasapaino. Miten tasapainotilaan voidaan vaikuttaa?
|
7.
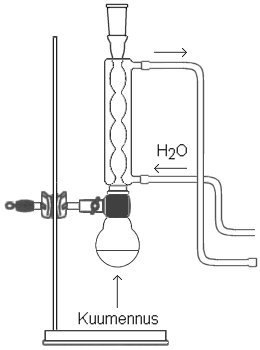
Tehtävänäsi on valmistaa
etyylimetanaattia eli metaanihapon etyyliesteriä käyttäen
oheisen kuvan mukaista laitteistoa. |
 |
Esteröityminen on tasapainoreaktio. Tasapainon muodostuminen on otettava huomioon synteesissä.
Vetyä voidaan valmistaa teollisesti käsittelemällä metaania vesihöyryllä:
Kun 1,00 litran astiaan suljettiin 0,100 mol metaania ja 0,120 mol
vettä ja lämpötila nostettiin 750 °C:seen, muodostui astiaan
tasapainotilan asetuttua 0,270 mol vetyä.
a) Laadi reaktion
tasapainovakion lauseke.
b) Laske tasapainovakion arvo.
c)
Muodostuiko vetyä enemmän vai vähemmän, kun astian
tilavuus muutettiin 0,500 litraksi? Perustele.
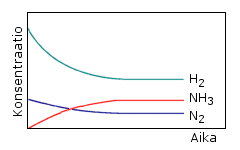
Erään reaktion kulkua voidaan havainnollistaa oheisessa
kuviossa esitetyllä tavalla.
a) Mistä reaktiosta on
kyse?
b) Miten kuviosta ilmenevät konsentraatiomuutokset
voidaan selittää?
c) Miten etenevän ja
käänteisen reaktion nopeus muuttuu reaktion aikana?
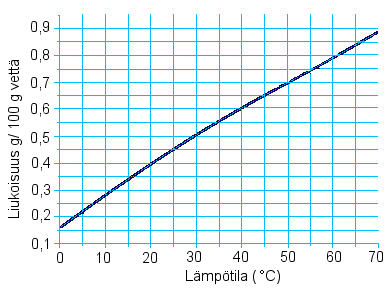
Oheisessa kuvassa on esitetty lyijy(II)kloridin liukoisuus grammoina 100 grammaan vettä eri lämpötiloissa.
0,75 grammaa lyijy(II)kloridia sekoitetaan 100 millilitraan
vettä.
a) Kuinka paljon PbCl2 jää
liukenematta lämpötilassa 20 °C?
b) Kuinka korkeaksi
tulee lämpötila nostaa, jotta kaikki PbCl2
liukenisi?
Laske kuvan avulla myös
c) lyijy(II) kloridin
liukoisuus (mol/l) lämpötilassa 35 °C,
d)
lyijy(II)kloridin liukoisuustulon arvo lämpötilassa 20 °C.
Korkeassa lämpötilassa vetyjodidi dissosioituu seuraavasti:
2 HI(g)
![]() H2(g) + I2(g)
H2(g) + I2(g)
a) Eräs tasapainoseos sisälsi 3,02 mol vetyjodidia, 0,32 mol jodia ja 0,52 mol vetyä. Tähän seokseen lisättiin 0,20 moolia jodia. Mikä oli seoksen koostumus astiassa, kun tasapainotila oli jälleen asettunut?
b) Osoita, että muodostuva tasapaino ei riipu reaktioastian tilavuudesta.
Typpidioksidi dimeroituu helposti dityppitetroksidiksi. Lämpötilassa 100 °C todettiin tasapainotilan vallitessa 1,0 litran reaktioastian sisältävän 0,20 moolia NO2(g) ja 0,20 moolia N2O4(g). Mitkä ovat näiden kaasujen ainemäärät, kun astian tilavuus muutetaan 0,50 litraksi ja tasapainotila jälleen asettuu?
15 millilitraan 0,0010 M hopeanitraattiliuosta
lisättiin 15 ml 0,0010 M natriumkloridiliuosta.
a) Osoita,
että astiaan saostuu hopeakloridia. (2 p.)
b) Laske hopeaionin
konsentraatio liuoksessa, kun tasapaino on asettunut. (4 p.) Hopeakloridin
liukoisuustulo on
Reaktion
tasapainovakio määritettiin seuraavalla tavalla. Eri määrät vetyjodidia suljettiin viiteen 0,400 litran astiaan, joita säilytettiin lämpötilassa 623 K. Tietyn ajan kuluttua astiat avattiin ja muodostunut jodi määritettiin titraamalla 0,0150 M natriumtiosulfaatilla reaktion
mukaisesti. Määritä näin saatujen kokeellisten tulosten perusteella reaktion tasapainovakion arvo. Mitkä seikat vaikuttavat tuloksen luotettavuuteen?
| Reaktioastian
numero |
HI(g):n
alkuperäinen määrä grammoina |
Astian
avaamisaika reaktion alusta lukien tunteina |
Titrauksessa
kuluneen tiosulfaatin tilavuus millilitroina |
| 1 | 0,300 | 2 | 20,96 |
| 2 | 0,320 | 4 | 27,90 |
| 3 | 0,315 | 12 | 32,31 |
| 4 | 0,406 | 20 | 41,50 |
| 5 | 0,280 | 40 | 28,68 |